Сепсис в современном обществе в связи с неуклонным ростом заболеваемости становится все более актуальной и пока не достаточно изученной проблемой медицинской науки. Обусловлено это объективными факторами, такими как увеличение количества инвазивных вмешательств, постарение населения, увеличение числа людей с хроническими заболеваниями, нарушения в иммунной системе и многие другие. Многочисленные исследования по изучению патогенеза и поиску новых путей решения этой проблемы не привели к снижению летальности от сепсиса, которая остается стабильно высокой – от 30 до 80%. [5]. Патогенез сепсиса включает изменения, возникающие в организме в результате неконтролируемого выброса цитокинов и других эндогенных медиаторов воспаления [13].
Для патогенеза сепсиса характерно также нарушение функционирования многих регулирующих гомеостаз систем. Это проявляется образованием токсических соединений и накоплением в аномально высоких концентрациях продуктов метаболизма, таких как лактат, пируват, креатинин, различных альдегидов, кетонов, биогенных аминов, лизосомальных белков и ферментов, цитокинов, продуктов перекисного окисления липидов, оксида азота, протеаз, свободных радикалов, иммунных комплексов, иммуноглобулинов и многих других [13, 16]. Сепсис имеет сходные звенья в патогенезе с сердечнососудистыми заболеваниями, так как в обоих случаях развивается эндотелиальная дисфункция, оксидативный стресс, нарушение гемостаза и обмена веществ [10, 12, 15, 19, 21]. О роли гомоцистеина при кардиоваскулярной патологии написано много статей и книг, а об изменении данной аминокислоты и ее метаболитов при сепсисе имеются лишь единичные публикации. В одном из немногочисленных исследовании у пациентов с политравмой, которая осложнялась сепсисом, было выявлено увеличение уровня гомоцистеина. Интересная закономерность прослеживалась относительно исхода сепсиса и концентрации гомоцистеина. У умерших пациентов уровень гомоцистеина был выше, чем у выживших [7].
При сепсисе происходит изменение обмена метионина и нарушение процессов трансметилирования [16]. Одним из образующихся при этом цитотоксичных метаболитов является гомоцистеин (Hcy). Накопление гомоцистеина в организме происходит как следствие дисбаланса между уровнем его наработки (S-аденозилметионин(SAM)-зависимые реакции) и удаления (реметилирование или транссульфурирование, выделение почками) [2, 16]. При сепсисе имеет место наработка в высоких количествах оксида азота, который является одним из известных ингибиторов ферментов транссульфурирования [13, 23]. Повышение гомоцистеина относят к факторам риска, участвующим в формировании дисфукнкции эндотелия сосудов, активации пролиферации гладкомышечных клеток, а также активации тромбоцитов и лейкоцитов [12]. В опытах, проведенных на животных, отмечено усиление гиперплазии неоинтимы после повреждения сосуда при высоком уровне гомоцистеина [10]. Некоторые исследователи указывают на то, что гомоцистеин влияет на функцию тканевого активатора плазминогена, стимулирует факторы свертывания (V, X, XII) и агрегацию тромбоцитов, а также ингибирует функцию естественных антикоагулянтов, таких как антитромбин III и протеин С [21]. На клеточном уровне гомоцистеин оказывает воздействие на активность процессов метилирования ДНК и протеинов, повышает экспрессию провоспалительных цитокинов, индуцирует оксидативный стресс [2]. Оксидативный стресс при гипергомоцистеинемии возникает в силу нескольких причин, во-первых, вследствие подавления ферментов-антиоксидантов (супероксид дисмутаз, глутатион пероксидазы, тиоредоксина) [19]. Во-вторых, из-за ингибирования Zn(II) содержащего фермента NG,NG-диметиларгинин диметиламиногидролазы (DDAH, EC 3.5.3.18), расщепляющего асимметричный диметиларгинин (aDMA), избыток которого ведет к ингибированию NO-синтаз (NOS) и способствует выработке большого количества свободных радикалов кислорода. Кроме того, гомоцистеин повышает чувствительность клетки к цитотоксическому действию агентов, способных генерировать свободные радикалы [19].
Втретьих, при гипергомоцистеинемии имеет место активация экспрессии прооксидантных ферментов, в том числе – НАДФН-оксидазы (Nox). Повышенные концентрации гомоцистеина при отсутствии достаточной антиокислительной защиты приводят к накоплению активных форм кислорода, следствием чего является дегенерация и фрагментация ДНК, активация поли(АДФ)-рибоза-полимеразы, истощение энергетических запасов клетки, высвобождение цитохрома C из митохондрий и активация проапоптозного каскада семейства каспаз, и в итоге – апоптоз / некроз клетки [2]. Общая концентрация гомоцистеина в плазме крови состоит из свободного (< 1%), связанного с белками (~ 80% связано с альбумином) и представленного в форме дисульфидов (цистин, Hcy-Cys и проч.), поэтому элиминация связанного гомоцистеина представляет некоторые трудности [9]. Так как гипергомоцистеинемия является повреждающим фактором при многих состояниях, активно изучаются возможности ее коррекции. Наиболее доступными факторами снижения уровня гомоцистеина являются витамины B2, В6, В12 и фолиевая кислота [2]. В ряде случаев это ведет к улучшению течения заболеваний, в частности ИБС [2]. Что же касается сепсиса, то в ответ на патогенетическое изменение пролиферативной активности лейкоцитов, в эксперименте, наблюдается дозозависимый рост концентрации гомоцистеина в среде инкубации, достигая 600% по сравнению с базовой величиной [11]. Интересно, что этот эффект подавляют противовоспалительные препараты – ацетилсалициловая кислота и ингибитор 3-гидрокси-3-метилглутарил коэнзим А редуктазы – аторвастатин [3, 4].
Других, не экспериментальных методов снижения гомоцистеина за короткий промежуток времени при сепсисе в литературе нами не найдено. Элиминация гомоцистеина изучалась при проведении программного гемодиализа (ГД) у пациентов с хронической почечной недостаточностью. При этом, несмотря на то, что содержание гомоцистеина в крови после сеанса стандартного ГД снижалось на 20-40%, общепризнанной является неэффективность диализной коррекции гипергомоцистеинемии, поскольку за 4-5-часовой сеанс ГД выводится лишь около 100 мкмоль гомоцистеина. Низкий уровень экскреции гомоцистеина при ГД обусловлен главным образом тем, что основная часть (примерно 80%) гомоцистеина плазмы циркулирует в связанном с белками виде [9]. Следует иметь в виду, что существует прямая положительная корреляция между концентрациями гомоцистеина, креатинина и мочевой кислоты в плазме крови, что, по всей вероятности, отражает тесное взаимодействие их обмена [15]. Если сравнить Km ферментов, метаболизирующих гомоцистеин, то он гораздо выше для транссульфурирования, чем реи транс-метилирования. Например, Km цистатионин β-синтазы (CBS) на порядок выше Km обеих гомоцистеин метилтрансфераз. Следовательно, реметилирование преимущественно протекает при низких концентрациях Hcy, в то время как CBS утилизирует гомоцистеин при высоких концентрациях [8]. Одним из продуктов реакции транссметилирования гомоцистеина является цистеин, повышенное содержание которого также оказывает цитотоксическое воздействие. Таким образом, данных по обмену гомоцистеина при сепсисе немного. В данной главе мы приведем данные нашего открытого рандомизированного исследования пациентов с сепсисом, которое включало 139 человек. Целью было изучение состояния обмена гомоцистеина при сепсисе и поиск методов его коррекции.
Материалы и методы
В ходе исследования обследовано 139 пациентов, проходивших лечение в отделении анестезиологии-реанимации и интенсивной терапии Учреждения здравоохранения «Гродненская областная клиническая больница». При поступлении пациентов с клиническими проявлениями сепсиса, отвечавшим критериям включения в исследование и не имевших противопоказаний к участию (критерии исключения), проводилась рандомизация с использованием программыгенератора случайных чисел [20] по 4 группам с использованием разных экстракорпоральных методов или без них. Пациентам с тяжелым сепсисом, при тяжести состояния по шкале APACHE II более 30 баллов, исходя из данных литературы, проводили операцию плазмафереза, как «терапию отчаянья» [22]. Критериями включения пациентов были: наличие диагноза «сепсис» различной степени тяжести (сепсис, тяжелый сепсис, септический шок или сепсис с полиорганной недостаточностью) и любой этиологии (абдоминальный, панкреатогенный, акушерский, менингеальный, тонзиллогенный, одонтогенный и др.) согласно критериям Согласительной Конференции Американского колледжа пульмонологов и специалистов критической медицины (1992 г.); возраст от 17 до 85 лет.
Пациент исключался из исследования при наличии любого из следующих критериев: беременность; острое нарушение мозгового кровообращения, инфаркт миокарда, коронарная ангиопластика или шунтирование в течение последних 6 месяцев до исследования; наличие злокачественной опухоли в организме; наличие ВИЧ-инфекции или хронического вирусного гепатита В или С; туберкулез легких или внутренних органов; эпилепсия с клонико-тоническими судорогами; неконтролируемая артериальная гипертензия, определяемая как 2 значения диастолического давления более 110 мм рт. ст. или 2 значения систолического артериального давления более 180 мм рт. ст.; наличие хронической почечной недостаточности любой стадии, цирроза печени, хронического алкоголизма и наркомании. Все больные получали традиционное лечение: антибиотики, инфузионная терапия, парентеральная и иммунокорригирующая терапия, респираторная и инотропная поддержка (при необходимости).
В группу 1 вошли 28 пациентов, которых лечили согласно стандартным протоколам лечения сепсиса без использования экстракорпоральных методов гемокоррекции. Группу 2 составили 10 пациентов: стандартные протоколы лечения сепсиса с использованием плазмафереза. Группа 3 включала 49 пациентов: стандартные протоколы лечения сепсиса с использованием гемосорбции через гемосорбент «Овосорб». Группа 4 – 37 пациентов: стандартные протоколы лечения сепсиса с применением гемосорбции через гемосорбент «Овосорб» с экстракорпоральной аутогемомагнитотерапией. Группа 5 – 15 пациентов: стандартные протоколы лечения сепсиса с применением гемосорбции через гемосорбент «Симплекс-Ф» с экстракорпоральной аутогемомагнитотерапией.
Исследуемые параметры изучали в 6 этапов – при поступлении (до проведения 1-й процедуры), затем через 1 час после 1-й процедуры, через 24 часа после 1-й процедуры, до 3-й процедуры, через 1 час после 3 процедуры и после всего курса терапии. В группе 1 показатели определяли при поступлении в отделение реанимации и после всего курса терапии. Статистическую обработку результатов осуществляли с использованием программы «Statistiсa 5.5». Медианой (Ме), верхней и нижней квартилями представлены величины, не имеющие приближенно нормальное распределение. Для принятия решения о виде распределения применялся критерий Шапиро-Уилка. Уровень значимости принят 5%. При сравнении независимых групп с ненормальным распределением значений одного или двух количественных признаков использовался непараметрический метод – критерий МаннаУитни с поправкой Бонферонни. При сравнении зависимых групп с ненормальным распределением значений использовался непараметрический метод – критерий Вилкоксона. Гомоцистеин, цистеин, глутатион, цистеин-глицин определяли в плазме крови методом высокоэффективной жидкостной хроматографии (HPLC – high-performance liquid chromatography) на аппарате «Agilent 1100» (Германия) с флуоресцентной детекцией с использованием высокореагентного восстановителя Tris(2-carboxyethyl)phosphin (TCEP) с последующей дериватизацией 7-флюоробензо-2-оксо-1,3диазол-4-сульфонатом аммония (SBD-F, ammonium 7fluorobenzo-2-oxa-1,3-diazole-4-sulfonate) фирмы «Fluca» (Германия) [6]. В качестве внутреннего стандарта использовали N-ацетилцистеин (NAC) [14].
Результаты и их обсуждение
В группе, которая включала 28 здоровых доноров станции переливания крови, уровень общего гомоцистеина составил 5,3 (4,4; 6,1) мкмоль/л, цистеина (Cys) 270 (224; 296) мкмоль/л, цистеин-глицина (CysGly) 23,7±4,9 мкмоль/л, глутатиона (GSH) 2,4±1 мкмоль/л, нитратов/нитритов 27 (25,6; 29) ммоль/л. Первоначально было изучено содержание гомоцистеина в плазме крови пациентов с сепсисом. Данные по изменению уровня гомоцистеина представлены в таблице 8.1. При поступлении у всех пациентов с сепсисом отмечается статистически значимое повышение содержания гомоцистеина в плазме крови по сравнению со здоровыми донорами (р<0,001, критерий Манна-Уитни с поправкой Бонферонни (U)). В ходе проведения и при завершении интенсивной терапии в группе 1, группе 2, группе 5, изменения количества цитотоксичной аминокислоты не происходит – сохраняется ее повышенный уровень. У пациентов группы 3 через через 24 часа после проведения первой гемосорбции отмечается тенденция к снижению уровня гомоцистеина с 9,4 мкмол/л до 7,26 мкмол/л. Через 1 час после третьей процедуры наблюдается противоположная тенденция – увеличение уровня гомоцистеина с 7,15 до 8,14 мкмол/л (р>0,05, критерий Вилкоксона). В группе 4 также отмечается тенденция к увеличению гомоцистеина через 1 час после проведения первой и третьей процедур. Но через 24 часа наблюдается сходная тенденция, как и в группе 3, снижение гомоцистеина.
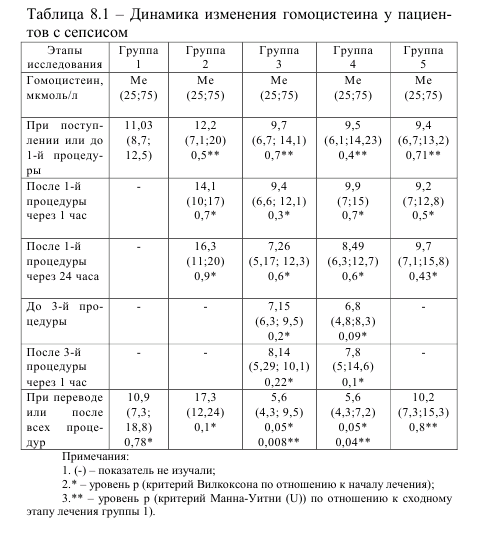
После завершения курса лечения в группе 3 и группе 4 при сравнении с начальным этапом отмечается достоверное снижение гомоцистеина до 5,6 мкмоль/л, что соответствует содержанию аминокислоты у здоровых доноров. Выявлено статистически значимое различие концентрации гомоцистеина между группой 1 и группой 3, а также между группой 1 и группой 4 на конечном этапе исследования (p<0,05, критерий Манна-Уитни с поправкой Бонферонни(U)). В группе 5 при проведении гемокарбоперфузии не выявлено изменения количества гомоцистеина в плазме пациентов с сепсисом. Одним из продуктов реакции трансметилирования гомоцистеина является цистеин, повышенное содержание которого также оказывает цитотоксическое воздействие. Его количество определяли в плазме крови. Данные по изменению уровня цистеина у пациентов с сепсисом представлены в таблице 8.2.
Таблица 8.2 – Динамика изменения цистеина у пациентов с сепсисом
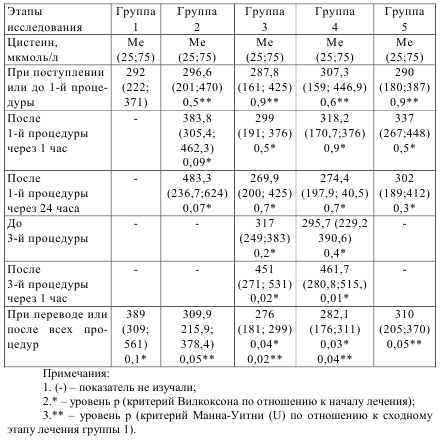
При сравнении уровня цистеина у пациентов с сепсисом при поступлении в ОАРИТ со здоровыми донорами значимого увеличения этой аминокислоты не выявлено (р>0,05 критерий Манна-Уитни с поправкой Бонферонни (U)). После проведения консервативной терапии в группе 1 отмечается тенденция к нарастанию количества цистеина в плазме крови пациентов с 292 до 389 мкмол/л. В группе 2 отмечается тенденция к увеличению цистеина с 296,6 до 383,8 мкмол/л через 1 час после проведения первого плазмафереза. Через 24 часа после плазмообмена содержание аминокислоты увеличилось до 483,3 мкмол/л (p>0,05 критерий Вилкоксона). Затем при исследовании после всего курса терапии у пациентов группы 2 и группы 1 наблюдалось статистически достоверное различие по содержанию цистеина (группа 2 – 309,9 мкмол/л, группа 1 – 389 мкмол/л (p=0,05, критерий Манна-Уитни (U)). В группе 3 и группе 4 после проводимых процедур наметилась тенденция к увеличению уровня цистеина, которая полностью исчезла через 24 часа. Статистически значимое увеличение цистеина выявлено после проведения трех гемосорбций в группе 3 c 317 до 451 мкмол/л, а в группе 4 с 295,7 до 461,7 мкмол/л. Но на следующие сутки количество аминокислоты приближалось к уровню здоровых доноров, и после всей комплексной терапии полностью нормализовалось (группа 3 – 276 мкмол/л, группа 4 – 282,1 мкмол/л). В конце терапии наблюдалось статистически достоверное различие между группой 1 (389 мкмол/л) и группой 3 (276 мкмол/л), а также группой 1 и группой 4 (282,1 мкмол/л) по содержанию цистеина (p<0,05, критерий Манна-Уитни с поправкой Бонферонни (U)). В группе 5 существенного изменения в содержании цистеина не происходило. После первой гемокарбоперфузии отмечено статистически недостоверное увеличение аминокислоты.
При завершении терапии отмечается статистически значимое различие между уровнем цистеина в группе 1 и группе 5. Изменение цистеина взаимосвязано с изменением гомоцистеина. После проведения первой и третьей гемосорбций как с магнитной обработкой крови, так и без неё, отмечается тенденция к увеличению аминокислот – гомоцистеина и цистеина. Также отмечается еще одна сходная закономерность, которая заключается в том, что через 24 часа после проведения сеанса гемосорбции происходит снижение уровня этих двух цитотоксичных аминокислот. На процессы изменения клеточного метаболизма гомоцистеина оказывает влияние ишемия и реперфузия тканей и органов. Первоначальный рост гомоцистеина и цистеина, возможно, связан с включением в кровоток тканей и органов, у которых отмечалась гипоперфузия, так как одним из эффектов гемосорбции через гемосорбент «Овосорб» является стабилизация гемодинамики улучшения микроциркуляции [1]. А затем в течение суток восстанавливается активность ферментов транссульфурирования, и происходит нормализация содержания гомоцистеина и цистеина. При сепсисе нарушаются механизмы антиоксидантной защиты. При сравнении концетрации глутатиона у пациентов с сепсисом во всех 5 группах отмечается достоверное ее увеличение по сравнению со здоровыми донорами (р<0,05). Данные по изменению уровня глутатиона у пациентов с сепсисом представлены в таблице 8.3. В группе 1 без экстракорпоральной детоксикации не наблюдается изменения глутатиона в плазме крови при проведении консервативной терапии, а сохраняется его повышенное количество в сравнении со здоровыми донорами на всех этапах исследования (р=0,1). В группе 2 отмечается статистически недостоверное снижение глутатиона после первой операции плазмафереза. На дальнейших этапах уровень был одинаковым – 3,4 мкмоль/л. При использовании гемосорбента «Овосорб» (группа 3) и в комбинации с магнитной обработкой крови (группа 4) отмечается тенденция к снижению глутатиона после первой процедуры с 4,25 до 2,9 мкмол/л и с 3,6 до 3,2 мкмоль/л, соответственно. Через 24 часа происходит статистически недостоверное увеличении глутатиона (группа 3 – 3,4 мкмоль/л,
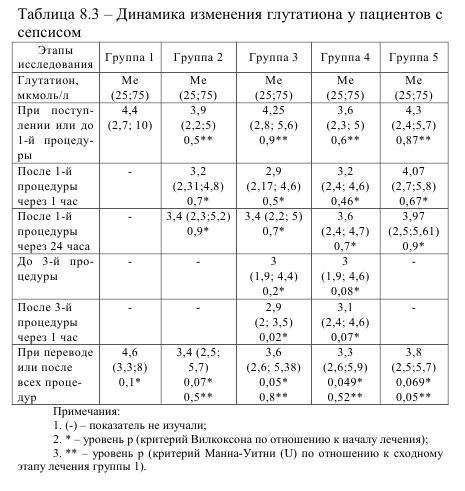
группа 4 – 3,6 мкмоль/л) в плазме пациентов. При завершении интенсивной терапии с использованием гемосорбции уровень глутатиона имеет тенденцию к снижению в группе 3 до 3,6 мкмоль/л и в группе 4 с использованием МОК до 3,3 мкмоль/л при сравнении с начальным этапом исследования. Возможно, снижение глутатиона после проведения гемоперфузии обусловлено его избыточным потреблением в результате компенсаторной реакции окислительного стресса, при ликвидации явлений нарушения микроциркуляции. Дальнейшая нормализация содержания глутатиона в группе 3 и группе 4 также связана со снижением концетрации его предшественника цистеина.В группе 5 статистически значимых изменений глутатиона в ходе исследования не было выявлено. После окончания интенсивной терапии уровень глутатиона был достоверно выше при сравнении группы 1, в которой не применяли методы экстракорпаральной гемокоррекции, со всеми остальными группами. Данные по изменению уровня цистеин-глицина у пациентов с сепсисом представлены в таблице 8.4.
Таблица 8.4 – Динамика изменения цистеин-глицина у пациентов с сепсисом
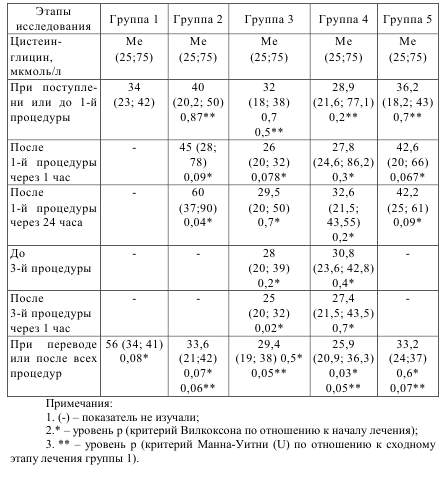
При дальнейшем изучении обмена глутатиона было также выявлено, что при поступлении у пациентов группы 1, группы 2, группы 3, группы 4 и группы 5 наблюдается повышенное содержание цистеин-глицина по сравнению со здоровыми донорами (р<0,05, критерий Манна-Уитни с поправкой Бонферонни). При дальнейшем проведении консервативной терапии без использования методов экстракорпоральной детоксикации в группе 1 наблюдается тенденция к росту этого метаболита в плазме крови. В группе 2 после плазмафереза наблюдается тенденция к росту цистеин-глицина, что проявляется в достоверном его увеличении через 24 часа после процедуры. После всей комплексной терапии уровень составил 33,6 мкмоль/л, что выше уровня здоровых доноров. У пациентов в группе 3 и группе 4 происходит после 1-й процедуры статистически незначимое уменьшение цистеинглицина после первой и после третьей процедуры. Через 24 часа после первой процедуры отмечается тенденция к росту данного метаболита. После проведения всех процедур наблюдается снижение цистеин-глицина до 29 мкмоль/л в группе 3 и до 25,9 мкмоль/л в группе 4, что достоверно ниже, чем содержание у пациентов группы 1 – 56 мкмоль/л. В группе 4 отмечается достоверное снижение уровня цистинглицина в сравнении с начальным этапом лечения. В группе 5 отмечается тенденция к увеличению цистеин-глицина после гемокарбоперфузии как через 1 час, так и через 24 часа. В конце терапии не получено различия между показателем цистеин-глицина в сравнении с начальным этапом лечения.
Полученные данные свидетельствуют о нормализации процессов обмена гомоцистеина при применении гемосорбции через антипротеиназный гемосорбент «Овосорб». Возможно, существует несколько путей достижения вышесказанного. Во-первых, увеличение концентрации гомоцистеина и цистеина после проведения сеанса экстракорпоральной детоксикации с применением гемосорбента «Овосорб» связано с улучшением микроциркуляции, что в дальнейшем и приводит к нормализации метаболизма и обмена метионина. Во-вторых, одним из механизмов может быть изменение пролиферативной активности лейкоцитов после гемосорбции, что способствует также нормализации оксидоредуктазных процессов в клетках, приводит к повышению уровня и активности цистатионин β-синтетазы (CBS) – скорость-лимитирующего фермента пути транссульфурирования Hcy, что позволяет спустя некоторое время (через 24 часа после процедуры) снизить уровень цитотоксичных аминокислот – цистеина и гомоцистеина. Уровень антиоксидантов глутатиона и его плазменного предшественника цистеин-глицина повышен. При этом снижается концетрация этих веществ к нормальным показателям только при проведении гемоперфузии через гемосорбент «Овосорб». Отмечена важная закономерность в связи уровня гомоцистеина и тяжести состояния больных по шкале APACHE II. Данные представлены в таблице 8.6. При поступлении отмечается положительная корреляционная связь между сравниваемыми показателями, но только статистически не значимая при анализе уровня тяжести пациентов по APACHE II. Таким образом, выяснилось несколько закономерностей: чем больше количество баллов по шкале APACHE II и SOFA, тем выше уровень гомоцистеина.
Таблица 8.6 – Корреляция тяжести состояния больных по шкале APACHE II, SOFA и уровня гомоцистеина
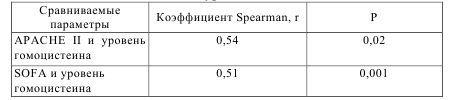
Также было изучено влияние на выживаемость уровня гомоцистеина в плазме крови. Анализ проводился с помощью регрессионной модели Кокса. В результате выявлено, что выживаемость ассоциирована с уровнем гомоцистеина как при поступлении, так и при завершении терапии. Данные анализа представлены в таблице 8.7.
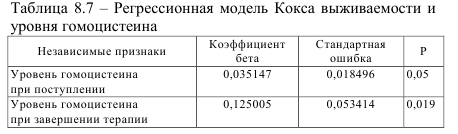
Таким образом, в зависимости от концентрации гомоцистеина наступает время летального исхода пациентов. Данные модели подтверждают ассоциации.
Выводы
- Уровень гомоцистеина и цистеина в плазме крови пациентов с сепсисом повышен.
- В процессе интенсивной терапии без применения экстракорпоральной гемокорекции уровни гомоцистеина и цистеина в плазме крови не снижаются.
- Применение гемоперфузии через антипротеиназный гемосорбент «Овосорб» позволяет нормализовать обмен гомоцистеина, его количество и содержание цистеина в плазме крови септических пациентов снижается до нормальных показателей.
- Уровень гомоцистеина коррелирует с оценкой тяжести состояния больных по шкалам APACHE II и SOFA.
- Концентрация гомоцистеина влияет на выживаемость пациентов с сепсисом.
Автор: В.А. Предко, В.В. Спас, УО «Гродненский государственный медицинский университет»