Для больных подагрой характерны высокие значения суммарного коронарного риска развития кардиоваскулярных катастроф, связанных с атеросклеротическим поражением сосудов [1]. В Фремингемском исследовании среди лиц, страдающих подагрой, было выявлено 60% случаев коронарной болезни сердца [17]. Исследование Gutmann A.B., которое является чуть ли не единственным, изучавшим исходы подагры за 20-летний период, показало, что не более четверти больных подагрой погибают от хронической почечной недостаточности, основная же причина смерти – это сердечнососудистые катастрофы [23].
Распространенность ишемической болезни сердца (ИБС) при подагре, а также риск кардиоваскулярных событий при подобных сочетаниях выше, чем в популяции в целом [3]. Krishnan E. и др. в исследовании MRFIT (Multiple Risk Factor Intervention Trial) показали, что среди больных подагрическим артритом без наличия коронарной болезни сердца в анамнезе имеется значительная положительная корреляция с последующим острым инфарктом миокарда (ОИМ) [29]. Choi H.K. et al. в проспективном исследовании изучали взаимосвязь между подагрой, риском смерти и инфарктом миокарда. В сравнении с лицами без подагры и кардиоваскулярной болезни мультивариантный относительный риск среди больных с подагрой был 1,28 для общей смертности, 1,38 для кардиоваскулярной смертности и 1,55 для фатальной коронарной болезни сердца. Для сравнения относительный риск среди лиц с предсуществующим кардиоваскулярным заболеванием был 1,25, 1,26 и 1,24, соответственно. Кроме того, у больных подагрой наблюдался более высокий риск нефатального инфаркта миокарда (относительный риск 1,59), чем у лиц без подагры [14].
В последнее время все больше внимания уделяется изучению «новых» факторов риска сердечно-сосудистых заболеваний у больных подагрой. По данным экспериментальных исследований, одним из важнейших путей реализации патогенетической связи подагры и ИБС является эндотелиальная дисфункция [2]. Одним из ключевых звеньев патогенеза развития эндотелиальной дисфункции является повышение уровня гомоцистеина и реализация его неблагоприятных биологических эффектов [10,40]. На сегодняшний день обмен гомоцистеина у пациентов с подагрой недостаточно изучен. В некоторых исследованиях была выявлена положительная корреляция между повышенным уровнем мочевой кислоты и уровнем гомоцистеина [16, 30, 31]. Неизвестно, имеется ли такая корреляция у больных подагрой, однако сам факт гипергомоцистеинемии у данной категории пациентов был выявлен в некоторых исследованиях. Так, Tsutsumi Z, Moriwaki Y. установили, что у японцев, страдающих подагрой, уровень гомоцистеина не был повышен [37]. С другой стороны, исследования, проведенные Istok R., Kovalancik M. в Европе, Cheng T.T., Lai H.M. в Тайване показали, что у больных подагрой был повышен уровень гомоцистеина [13, 27]. Cheng и соавторы показали, что у больных подагрой уровень гомоцистеина в плазме крови значительно больше (12,0±3,19 мкмоль/л), чем в контрольной группе (9,96±4,68 мкмоль/л). Не было достоверных различий в группах до лечения аллопуринолом (12,54±3,31) и после лечения аллопуринолом (11,90±4,68) [13].
Кроме сосудистых эффектов повышение уровня гомоцистеина может способствовать повышению уровня мочевой кислоты, что реализуется через увеличение концентрации ниацина. Возможно, увеличение концентрации мочевой кислоты у больных подагрой кроме дефектов пуринового метаболизма, происходит также вследствие уменьшения образования S-аденозилметионина (SAM) из-за снижения реметилирования гомоцистеина, что приводит к увеличению концентрации ниацина, который входит в состав никотинамидадениндинуклеотида (НАД). Скорость распада НАД, в свою очередь, зависит от метилирования SAM. При гипергомоцистеинемии происходит увеличение концентрации ниацина и уменьшение экскреции мочевой кислоты, повышение ее уровня и утяжеление симптомов подагры [19, 33]. Ниацин (витамин PP) конкурирует с мочевой кислотой за экскрецию, и применение его в составе препаратов (в частности, ксантинола никотината) у больных подагрой нежелательно. Таким образом, при подагре, кроме гиперурикемии, связанной с патогенезом данного заболевания, при нарушении обмена серосодержащих аминокислот, в частности, при нарушении катаболизма гомоцистеина, могут возникать дополнительные механизмы, приводящие к повышению концентрации мочевой кислоты у этих больных. С другой стороны, нарушение пуринового обмена также может приводить к нарушению обмена серосодержащих аминокислот. Установлено, что в присутствии аденозина гомоцистеин активно конвертируется в SAH, потенциальный ингибитор метилтрансфераз [25].
Основной механизм неблагоприятных действий гомоцистеина – это гипометилирование через накопление SAH [25, 35]. Учитывая, что у больных подагрой происходит нарушение метаболизма компонентов пуринового обмена и их накопление, можно предположить, что повышенный уровень аденозина у таких больных будет приводить к сдвигу реакций в сторону образования SAH. Кроме того, недавно было выявлено, что гомоцистеин в присутствии аденозина ингибирует рост эндотелиальных клеток путем снижения карбоксиметилирования p21ras [39]. Внеклеточный аденозин вместе с гомоцистеином вызывал апоптоз культивируемых эндотелиальных клеток легочной артерии вследствие увеличения концентрации SAH, который ингибирует изопренилцистеин карбоксиметилтрансферазу, в итоге приводя к активации сигнальных молекул, запускающих апоптоз [28].
Исходя из этого, можно предположить более выраженное неблагоприятное действие гомоцистеина у больных подагрой на состояние эндотелия сосудов и на параметры эндотелийзависимой вазодилатации. Целью нашего исследования было: разработка патогенетически обоснованных рекомендаций по коррекции дисфункции эндотелия и профилактике риска развития кардио-васкулярной патологии у пациентов с подагрой с учетом нарушения метаболизма серосодержащих аминокислот и фолатного статуса.
В данной главе представлены данные комплексного обследования пациентов с подагрой как без кардиоваскулярной патологии, так и в сочетании с ИБС и АГ, а также здоровых лиц единой возрастной группы, дана характеристика функционального состояния эндотелия плечевой артерии, определены показатели метаболизма серосодержащих аминокислот, уровень фолатов и параметры артериальной жесткости. С помощью корреляционного анализа определена роль нарушения метаболизма серосодержащих аминокислот и дефицита фолиевой кислоты в развитии дисфункции эндотелия, дано обоснование технологии метаболической коррекции в составе комплексной патогенетической терапии и проведена оценка ее эффективности.
Материал и методы исследования
Исследования проводились на базе кафедры госпитальной терапии и УО «Гродненского государственного медицинского университета», ревматологического отделения гродненской областной клинической больницы и ревматологических кабинетов городских поликлиник г. Гродно.
Клиническая характеристика обследованных больных
Нами было обследовано 99 пациентов с подагрой без кардиоваскулярной патологии, 30 пациентов с подагрой в сочетании с ИБС и АГ и 40 практически здоровых лиц, сопоставимых по полу и возрасту, c нормальным артериальным давлением, без отягощенной наследственности по сердечнососудистой патологии. Для обследования отбирались амбулаторные больные, состоящие на диспансерном учете по поводу подагры у ревматологов в городских поликлиниках г. Гродно, а также больные, находившиеся на стационарном лечении в ревматологическом отделении Гродненской областной клинической больницы. Противопоказаниями к включению в группу пациентов без кардиоваскулярной патологии являлись: клинические проявления ИБС и признаки коронарной недостаточности при велоэргометрии, признаки гипертрофии левого желудочка по данным ЭКГ, артериальная гипертензия, сахарный диабет и другая эндокринная патология, синдромы почечной и печеночной недостаточности, геморрагический синдром, анемия, заболевания бронхолегочной системы. Средний возраст больных составил 47,34±7,55 лет, все больные – лица мужского пола. Длительность заболевания составила от 0,5 до 15 лет (в среднем 6,9±2,3 года) [4, 7, 9]. В группу пациентов с подагрой в сочетании с ИБС и АГ были включены лица с верифицированным диагнозом стабильной стенокардии напряжения 2-го функционального класса и артериальной гипертензией не выше 2-й степени по данным офисного измерения АД и холтеровского мониторирования.
Диагноз подагры устанавливали согласно критериям Американской ревматологической ассоциации:
A. Наличие характерных мононатриевых уратных кристаллов в синовиальной жидкости 1. B. Подтвержденный тофус (химическим анализом или поляризационной микроскопией)1. C. Наличие 6 из 12 клинических, лабораторных и рентгенологических признаков:
1. Максимальное воспаление сустава в первый день.
2. Наличие более чем одной атаки артрита.
3. Моноартрит.
4. Покраснение суставов.
5. Боль и воспаление ПФС первого пальца.
6. Асимметричное воспаление ПФС.
7. Одностороннее поражение тарзальных суставов.
8. Подозрение на тофусы.
9. Гиперурикемия.
10. Асимметричное воспаление суставов.
11. Субкортикальные кисты без эрозий при рентгенологическом исследовании.
12. Отсутствие микроорганизмов в культуре синовиальной жидкости.
Всем пациентам и здоровым в процессе диагностики проводилось обследование, включавшее общий осмотр, измерение артериального давления, лабораторные исследования: общий анализ крови и мочи, биохимический анализ крови – общий белок, мочевина, креатинин, мочевая кислота, глюкоза, общий билирубин, общий холестерин, общие липиды, аспартатаминотрансфераза, аланинаминотрансфераза, Среактивный белок, ревматоидный фактор. Регистрировалась ЭКГ в 12 общепринятых отведениях, проводилась велоэргометрия для исключения скрытой коронарной недостаточности. Также в плазме крови определялись концентрации общего фолата, аминокислот, в том числе серосодержащих, метаболиты пуринового обмена, показатели эндотелийзависимой и эндотелийнезависимой вазодилатации.
Обследование больных проводилось вне обострения подагрического артрита, при отсутствии острофазовых показателей крови и с отменой любых препаратов (в том числе аллопуринола) за 5-7дней до обследования, после которого больные были разбиты на 2 группы. Первую группу составили 50 человек, которые принимали аллопуринол в дозе 100 мг три раза в день (суммарная доза 300 мг). Вторую группу составили 49 человек, которые принимали комплексное лечение – аллопуринол 300 мг, фолиевую кислоту 0,3 мг, витамин В6 – 5мг в сутки. Пациенты с подагрой в сочетании с ИБС и АГ получали аллопуринол 300 мг в сутки, фолиевую кислоту 0,5 мг, вит. В6 -5мг, лозартан 100 мг, метопролол 100 мг в сутки. Лечение проводилось в течение месяца, после чего проводилось повторное определение функциональных и биохимических показателей.
Исследования функционального состояния эндотелия
Для изучения вазодилататорной активности эндотелия сосудов у больных подагрой нами использована функциональная окклюзионная проба с объективным контролем степени вазодилатации реографическим методом. Скорость постишемического кровотока после пережатия артерии в несколько раз превышает исходную и в течение 1-2 минут снижается к доокклюзионному уровню. Окклюзия артериального кровотока вызывает снижение pO2 и резкое увеличение напряжения сдвига на эндотелий (в момент реокклюзии), что проиводит к повышению активности его механорецепторов, обуславливая повышение NO-синтазной активности эндотелия, высвобождение NO и развитие дилатации сосудов – постокклюзионной реактивной гиперемии [12,32]. Исследование эндотелийзависимой реакции плечевой артерии (ПА) в ответ на пробу с реактивной гиперемией (РГ) осуществляли методом реовазографии с помощью аппаратнопрограммного комплекса “Импекард”. В качестве информативной реографической величины оценивалось изменение максимальной скорости кровотока (Δdz/dt),% – показатель вазомоторной функции эндотелия (ВФ), вызванное реактивной гиперемией [8]. За 30-40 минут до исследования больной принимает 25 мг ортофена для блокады простациклин-зависимой активности эндотелия. Измеряется уровень артериального давления. Вводится и автоматически анализируется реовазографический сигнал исходного состояния. Затем в компрессионную манжетку нагнетается воздух до уровня, превышающего систолическое артериальное давление на 50 мм рт. ст. Продолжительность компрессии составляет 5 мин. Через 1 минуту после декомпрессии повторно вводится и анализируется реовазографический сигнал. Вычисляется относительное изменение максимальной объемной скорости кровенаполнения.

Изучение эндотелийнезависимой вазодилатации проводилось методом нитроглицериновой пробы. Экзогенно введенный NO активирует растворимую гуанилатциклазу. В результате повышается уровень ц-ГМФ в миоцитах, что приводит к их релаксации и расширению сосудов. Индуцированная нитроглицерином релаксация проявляется на 5-й минуте максимальным приростом пульсового кровотока периферических сосудов. Анализ степени прироста пульсового кровотока в ответ на прием нитроглицерина дает возможность судить о сохранности гуанилатциклазного, независимого от эндотелия, механизма вазодилатации.
Методика определения скорости распространения пульсовой волны
При исследовании СРПВ используется четыре концентрических электрода. Для регистрации реограммы с центральной – сонной – артерии первая пара электродов накладывается в области шеи: один – на переднешейной борозде на уровне верхнего края щитовидного хряща, другой на этом же уровне со смещением на 2 см кзади. Вторая пара электродов накладывается в зоне максимальной пульсации лучевой артерии в районе запястья. Для оценки временного параметра распространения пульсовой волны вычисляется разность между временем начала комплекса реограммы сонной артерии и временем начала соответствующего комплекса реограммы лучевой артерии. Вычисленные разности усредняются по числу синхронно размеченных комплексов и результирующее значение принимается за время распространения пульсовой волны у данного пациента. Для оценки СРПВ измеряются расстояния от яремной ямки до реоэлектрода на запястье и от яремной ямки до реоэлектрода на сонной артерии. В качестве длины пути при распространении пульсовой волны принимается разность измеренных расстояний. Скорость пульсовой волны рассчитывается как отношение вычисленного расстояния ко времени запаздывания пульсовой волны. Реовазографический порог критерия СРПВ определен как С=10,2 м/с. Превышение данного уровня характерно для состояния сосудов верхних конечностей больных сердечно-сосудистой патологией. Величины СРПВ ниже 10,2 м/с соответствуют диапазону нормальных значений.
Определение концентраций серосодержащих аминокислот в плазме крови
Количественная и качественная идентификация свободных аминокислот и их дериватов проводилась обращеннофазной хроматографией с предколоночной дериватизацией 0,4% о-фталевым альдегидом и 0,3% 3-меркаптопропионовой кислотой в 0,4М Na-боратном буфере, pH 9,4. Детектирование по флуоресценции (231/445 нм, начиная с времени выхода пиков пролина и оксипролина и до конца хроматограммы –260/313 нм). Идентификация и количественная оценка полученных значений производилась программой Agilent ChemStation A10.01 путем сравнения результатов анализа исследуемых биологических объектов со стандартной калибровочной кривой искусственной смеси аминокислот. Последняя содержала равные количества определяемых соединений по 250 нмоль/мл каждого и обрабатывалась так же, как соответствующие пробы (плазмы или ткани). Использовался концентрат стандартной смеси физиологических аминокислот фирмы "Calbiohem" (США). Использовалась колонка Zorbax XDB C8, 3,5 мкм, 3х150 мм. Подвижная фаза А: 0,1 М Naацетатный буфер, pH 6,85, содержащий 20 мг/л ЭДТА; подвижная фаза В: ацетонитрил/вода 6/4 (об./об.). Разделение проводили с градиентным элюированием от 5 до 100% В за 78 мин.; температура колонки 37°С. Для определений использовали хроматограф Agilent 1100. Тридистиллированную воду для подвижных фаз пропускали через патрон «Norganic» (Millipore, США), подвижные фазы фильтровали через мембранный фильтр 0,22 мкм.
В описанной системе последовательно элюировались и определены следующие соединения: таурин, цистеин, метионин, цистатионин, цистеинил-глицин. Содержание общего гомоцистеина в плазме крови определяли после предколоночной дериватизации тиолов с аммоний-7-фторбензол-2-оксо-1,3-диазола-4-сульфонатом (SBDF) [26] методом обращенно-фазной ВЭЖХ с изократическим элюированием, представляющим собой модификацию метода, предложенного Ubbink et al. [44]. Для восстановления тиолов из дисульфидов и высвобождения связанных с белками тиолов использовался трис(карбоксиэтил)фосфин гидрохлорид (TCEP), при этом использовалась модификация процедуры, описанной Gilfix et al. [21]. К плазме крови добавляли N-ацетилцистеин до конечной концентрации 100 мкМ (внутренний стандарт). Разделение осуществляли на колонке Диасорб 130 С16Т, 3х250 мм, 7 мкм. Подвижная фаза: 0,1 М NaH2PO4, 17 мМ CH3COOH, pH 3,65, 40 мг/л ЭДТА, 3% ацетонитрила. Скорость потока 0,6 мл/мин, температура колонки 30°С. Пробы плазмы крови (50 мкл) смешивали с 5 мкл раствора TCEP (100 мг/мл), после чего оставляли при комнатной температуре на 30 мин. Затем осаждали белки добавлением 50 мкл 10% раствора ТХУ и центифугировали при 4°С 15 мин. при 16000 g. В микропробирку на 200 мкл, содержащую 2 мкл 1,55 М NaOH, 12,5 мкл 0,125 М Na-боратного буфера, содержащего 200 мг/л ЭДТА, pH 9,5, и 5 мкл раствора SBD-F (1 мг/мл) в таком же буфере, вносили 10 мкл супернатанта и инкубировали 1 час при 60°С. В хроматографическую систему вводили 10 мкл реакционной смеси. Детектирование по флуоресценции, 379/510 нм. Определения проводили на хроматографической системе Agilent 1100, содержащей 4-канальный градиентный насос, термостат колонок, автосамплер и детектор флуоресценции. Регистрация хроматограмм и их количественная обработка осуществлялись с помощью Agilent ChemStation A10.01.
Исследование липидного обмена
Исследование параметров липидного обмена проводилось в сыворотке, полученной сразу же после взятия крови из вены на фотометре, автоматизированном ЗФ 2660 ЗАО «Солар». Общий холестерин, триацилглицерины определялись прямым энзиматическим ПАП методом (p-аминоптерин) с образованием хинонеиминового остатка красного цвета. Интенсивность окраски производного хинонеимина прямо пропорциональна концентрации общего холестерина, триацилглицеринов в пробе. Уровень холестерина липопротеинов высокой плотности (ХС ЛПВП) определялся фотометрическим ферментативным методом с осаждением липопротеинов низкой плотности (ХС ЛПНП), липопротеинов очень низкой плотности (ХС ЛПОНП) и их «ремнантов» с помощью фосфорно-вольфрамовой кислоты и хлорида магния. В надосадочной жидкости определялся ХС ЛПВП. В ходе реакции образуется хинонеиминовый остаток красного цвета. Интенсивность окраски производного хинонеимина прямо пропорциональна концентрации ХС ЛПВП. Концентрация ХС ЛПНП рассчитывалась в соответствии с уравнением Friedewald et al.
ХСЛПВП=ХС – (ХС ЛПВП)-ТГ/2,2, где ТГ/2,2= ХС ЛОПНП Расчет атерогенности проводился по формуле: КА=(ХС-ХС ЛПВП)/ ХС ЛПВП
Определение фолатов в плазме крови
Для анализа количества фолацина использовали коммерческие наборы радиоиммунного исследования SimulTRAC-SNB (MP Biomedicals, Orangeburg, USA). Фолатпроизводные плазмы крови анализировались после обработки образцов радиоактивным лигандом (I125) и дитиотрейотолом, и последующим экстрагированием в щелочной среде. В качестве стандарта использовали птероилглутаминовую кислоту в инкубационной среде при Ph 9,5. Разницу в уровне радиоактивности контрольной и опытной проб измеряли автоматическим гамма-счетчиком Wallac 1470 Wizard (Швеция).
Методика нагрузочного теста с метионином
Утром натощак у обследуемого производился забор крови, которую собирали в пластиковые пробирки, содержащие 10% раствор Na2EDTA, и центрифугировали 15 мин. при 3000 g. Затем пациент принимал L-метионин в дозе 50 мг/кг массы тела в виде порошка, растворенного во фруктовом соке. В течение проведения нагрузочной пробы больному разрешался низкокалорийный и с ограничением белка завтрак. Через 4 часа у больного повторно проводился забор крови. Методом ВЭЖХ определялись уровни метионина и его метаболитов до и через 4 часа после нагрузки. Также определялась концентрация метаболитов пуринового обмена до и после нагрузки [5, 6].
Статистическая обработка результатов исследования
Статистическая обработка проводилась с помощью пакета прикладных программ Microsoft Excel 2010 и STATISTICA 6.0. Была использована простая описательная статистика. Ее результаты представлены в виде средних значений (M) и средних квадратических отклонений (SD) для количественных признаков, имеющих нормальное распределение, медианы (Me) и интерквартильного интервала [25%; 75%] для неправильно распределенных анализируемых признаков. Качественные признаки описывались абсолютными и относительными частотами. Анализ взаимосвязи двух признаков проводился с использованием непараметрического корреляционного анализа по методу Спирмена. Результаты этого анализа представлены коэффициентом корреляции – r – и значением р. Для сравнения двух независимых групп мы использовали непараметрический критерий Манна-Уитни (U-тест). Для сравнения частот качественных признаков в несвязанных группах применялись точный критерий Фишера, в зависимых группах критерий χ2.
Функциональное состояние эндотелия плечевой артерии, скорость распространения пульсовой волны, обмен серосодержащих аминокислот и уровень фолиевой кислоты у пациентов с подагрой без кардиоваскулярной патологии и в сочетании с ИБС и АГ
В данном разделе приведены результаты собственных исследований группы больных с подагрой без кардиоваскулярной патологии (99 человек), а также в сочетании с ишемической болезнью сердца и артериальной гипертензией (30 человек) и практически здоровых лиц (n=40), некурящих мужчин без отягощенной наследственности по ИБС.
Уровни серосодержащих аминокислот, фолата в плазме крови, функциональное состояние эндотелия плечевой артерии и скорость распространения пульсовой волны у практически здоровых лиц
Контрольную группу составили 40 практически здоровых, некурящих мужчин, с нормальным артериальным давлением, без отягощенной наследственности по ИБС, с отсутствием указаний на заболевания респираторной, сердечнососудистой систем, желудочно-кишечного тракта и эндокринной системы. Средний возраст обследуемых составил 43,62±7,4 лет. Лица этой группы жалоб на состояние здоровья в момент обследования не предъявляли. Результаты определения концентраций серосодержащих аминокислот у практически здоровых лиц представлены в таблице 5.1.
Таблица 5.1 – Концентрация серосодержащих аминокислот у практически здоровых лиц.
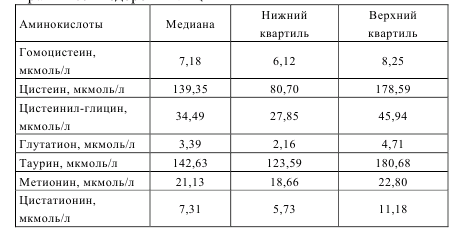
Содержание гомоцистеина в плазме крови у практически здоровых лиц составило 7,18 (6,12-8,25) мкмоль/л. Отмечалась положительная корреляция между уровнями гомоцистеина и цистеина (R=0,52, p=0,0012), так как гомоцистеин через образование цистатионина превращается в цистеин, и отрицательная между концентрациями гомоцистеина и таурина (R= -0,41, p=0,025), что, возможно, свидетельствует о преимуществе реутилизации гомоцистеина путем реметилирования, а не транссульфурирования. У здоровых не было взаимосвязей между уровнем гомоцистеина и пуриновыми метаболитами. Цистеин у здоровых лиц положительно коррелировал с цистеинилглицином (r=0,45, p=0,006) и не было достоверных корреляций с метаболитами пуринового обмена. Уровень глутатиона в контрольной группе составил 3,39 (2,16-4,71) мкмоль/л и положительно коррелировал с уровнем аденозина (r=0,52, p=0,003). Не было выявлено корреляций цистеинилглицина, метионина и цистатионина с пуриновыми метаболитами [4, 9]. Результаты исследования функционального состояния эндотелия плечевой артерии, скорости распространения пульсовой волны и концентрации фолатов в плазме крови у практически здоровых лиц представлены в таблице 5.2.
Таблица 5.2 – Показатели функционального состояния эндотелия плечевой артерии, скорости распространения пульсовой волны и концентрации фолатов в плазме крови у здоровых лиц.
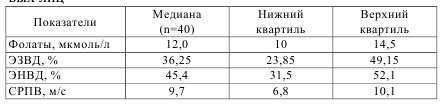
Как видно из таблицы, показатель эндотелийзависимой вазодилатации составил 36,25% (23,85-49,15), а эндотелийнезависимой – 45,4% (31,5-52,1). В контрольной группе не наблюдалось корреляций между ЭЗВД и метаболитами пуринового обмена, в том числе мочевой кислотой. Также в контрольной группе не было выявлено корреляций между содержанием серосодержащих аминокислот и показателями эндотелийзависимого ответа. Скорость распространения пульсовой волны у здоровых лиц колебалась от 6,8 до 10,1 м/с и в среднем составила 9,7 м/с. Уровень фолатов в плазме крови практически здоровых лиц колебался от 10 до 14,5 мкмоль/л [4, 7, 9].
Показатели метаболизма серосодержащих аминокислот, уровень фолатов, функциональное состояние эндотелия плечевой артерии и скорость распространения пульсовой волны у пациентов с подагрой без кардиоваскулярной патологии
У больных подагрой были определены концентрации серосодержащих аминокислот. Данные представлены в таблице 5.3.

У больных подагрой отмечается значительное повышение концентрации гомоцистеина в сравнении с практически здоровыми лицами, а также цистеина и цистеинилглицина. В то же время, снижены концентрации таурина и цистатионина. Наблюдаемая у практически здоровых лиц отрицательная корреляция гомоцистеина и таурина (R=-0,41, p=0,025) у больных отсутствует (r=0,16, p=0,31). Если в контрольной группе не было выявлено корреляций между серосодержащими аминокислотами и пуриновыми метаболитами, то у пациентов с подагрой таковые имелись. Так, уровень цистеина обратно коррелировал с уровнем гипоксантина (R= -0,29, p=0,013) и ксантина (R= -0,42, p=0,0002) [5, 6, 7, 9]. Показатели функционального состояния эндотелия плечевой артерии, скорость распространения пульсовой волны и концентрация фолатов в плазме крови у больных подагрой представлены в таблице 5.4. Как видно из представленных данных, кроме метаболических нарушений, у пациентов с подагрой выявлено нарушение вазомоторной функции эндотелия, которое проявляет-
Таблица 5.4 – Показатели функционального эндотелия плечевой артерии, скорость распространения пульсовой волны и концентрация фолатов в плазме крови у больных подагрой (медиана (нижний квартиль – верхний квартиль)).
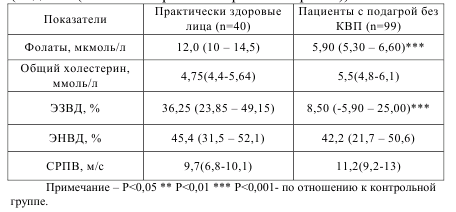
ся уменьшением эндотелийзависимой вазодилатации. У пациентов с подагрой в сравнении со здоровыми лицами значительно снижен эндотелийзависимый ответ (8,50 (-5,90-25,00) vs. 36,25% (23,85-49,15)), в то же время показатели эндотелийнезависимого ответа практически не отличались (таблица 5.4).
По показателям ЭЗВД у пациентов была выявлена следующая градация:
33 человека (33,3%) – ВФ эндотелия не нарушена; (dz/dt) >12%
38 человек (38,4%) – умеренно выраженное нарушение ВФ эндотелия;
(dz/dt) = (-2–12)% 17 человек (17,2%) – выраженное нарушение ВФ эндотелия; (dz/dt) < (-2 – -15)%
11 человек (11,1%) – резко выраженное нарушение ВФ эндотелия; (dz/dt) < -15%
Таким образом, у 66,7% пациентов с подагрой имеется нарушение ЭЗВД. Корреляционный анализ показал, что у них ЭЗВД обратно коррелировала с уровнем гомоцистеина (R= -0,49, P=0,000001), в то время как у здоровых лиц между ЭЗВД и уровнем гомоцистеина достоверной корреляции не было. У больных ЭЗВД также обратно коррелировала с уровнем цистеина (R= -0,22, p=0,03), мочевой кислоты (R= -0,25, p=0,038) [4, 7] и СРПВ (R= -0,24, p=0,04). По содержанию фолатов в группе больных подагрой отмечалось снижение уровня фолатов (5,90 (5,30-6,60) мкмоль/л у больных и 12,0 (10-14,5) мкмоль у здоровых). Выявлена также корреляция между ЭЗВД и уровнем фолатов (r=0,29, p=0,003) в плазме крови пациентов, что свидетельствует о важной роли фолатов в регуляции функционального состояния эндотелия. Кроме того, выявлена отрицательная корреляция между уровнем фолатов и гомоцистеина (R= -40,4; p=0,00152). Таким образом, чем выше у больных концентрации гомоцистеина, цистеина и мочевой кислоты, больше СРПВ и ниже концентрация фолата, тем хуже эндотелийзависимый ответ. Однако между уровнем гомоцистеина и ЭЗВД более сильная корреляция, чем между уровнем мочевой кислоты и ЭЗВД, что может свидетельствовать о большей роли уровня гомоцистеина в развитии ДЭ, чем уровня мочевой кислоты. Особое внимание на себя обращает отрицательная корреляция между ЭЗВД и цистеином, которая свидетельствует в пользу того, что цистеин у больных подагрой может быть фактором риска сердечно-сосудистой патологии.
Отрицательная корреляция между ЭЗВД и СРПВ объясняется тем, что СРПВ увеличивается при уплотнении сосудистой стенки, что наблюдается при атеросклеротическом процессе, в то же время эндотелийзависимый ответ ухудшается. Кроме того, поскольку фолиевая кислота является изостерическим ингибитором ксантиноксидазы, пониженный уровень фолатов в плазме крови пациентов с подагрой может способствовать повышенной активности последней и тем самым увеличению уровня мочевой кислоты [4, 7]. У здоровых лиц не выявлено достоверной корреляции ЭЗВД ни с одним показателем, в том числе гомоцистеином, цистеином, таурином, общим холестерином, что свидетельствует о том, что при нормальных концентрациях последних эндотелий интактен. Как видно из полученных данных, при отсутствии клинических проявлений сердечно-сосудистых заболеваний у обследуемых пациентов, при нормальных показателях ЭНВД и СРПВ, имеется нарушение эндотелийзависимой вазодилатации и гипофолатемия, что является предиктором к развитию заболеваний сердечно-сосудистой системы.
Сравнительная оценка показателей серосодержащих аминокислот, вазомоторной функции эндотелия плечевой артерии, скорости распространения пульсовой волны и уровня фолатов у пациентов с подагрой с дисфункцией и без дисфункции эндотелия
Для более детального выяснения роли каждого фактора в развитии дисфункции эндотелия мы рассмотрели также показатели метаболизма серосодержащих аминокислот отдельно у пациентов с подагрой с дисфункцией эндотелия и без дисфункции эндотелия, что позволило выявить важные различия, представленные в нижерасположенных таблицах. Как видно из данных, представленных в таблице 5.5, у пациентов без дисфункции эндотелия уровень гомоцистеина выше, чем в контрольной группе, но существенно ниже, чем в группе с ДЭ, при этом отмечалась также большая разница в показателях ЭЗВД, уровня фолатов, что отображено в таблице 5.6. Так, повышение уровня гомоцистеина на 4,2 мкмоль/л у пациентов с подагрой в сочетании с дисфункцией эндотелия сопровождалось десятикратным уменьшением показателей эндотелийзависимой вазодилатации от 29,4% до 2,4% на фоне гипофолатемии (5,0 мкммоль/л).
Это подтверждается отрицательной корреляцией между ЭЗВД и концентрацией гомоцистеина (R= -0,37; p=0,002). Несмотря на то, что уровень мочевой кислоты в обеих группах был одинаков, различие по показателям ЭЗВД было зарегистрировано десятикратное. Из чего можно заключить, что нарушение эндотелийзависимой вазодилатации у пациентов с подагрой в большей степени зависит от уровня гомоцистеина и фолиевой кислоты в плазме крови. Это показывает положительная корреляция между фолиевой кислотой и ЭЗВД (R=0,47; p=0,04) в группе пациентов с ДЭ. Ранее проведенные исследования показывали наличие у больных подагрой повышенного уровня гомоцистеина и наличие эндотелиальной дисфункции, однако не связывали одно с другим [1].


Считалось, что эндотелиальная дисфункция у больных подагрой была вызвана в основном гиперурикемией и другими сопутствующими факторами. Однако на сегодняшний день единого мнения насчет этого нет. И, более того, как следует из наших данных, существенный вклад в развитие эндотелиальной дисфункции вносит нарушение обмена серосодержащих аминокислот, которое возникает как вследствие дефицита фолиевой кислоты, так и нарушения пуринового обмена, взаимосвязь между которыми была нами доказана в ходе выполнения нагрузки метионином. Кроме того, в группе пациентов с ДЭ выявлена отрицательная корреляция между уровнем холестерина и ЭЗВД (R= –0,40; p=0,0014). В группе пациентов без ДЭ такой корреляции не было выявлено.
Таким образом, в развитии дисфункции эндотелия у пациентов с подагрой участвует комплекс неблагоприятных факторов, а не только уровень мочевой кислоты. Если проанализировать концентрации таурина и цистеина в группе здоровых лиц и группах пациентов с дисфункцией и без дисфункции эндотелия, то видно, что концентрация таурина прогрессивно снижается, а цистеина – повышается с максимальным значением в группе с ДЭ. Поскольку таурин синтезируется из цистеина, то повышение уровня цистеина у пациентов, при одновременном снижении концентрации таурина, свидетельствует об уменьшении синтеза таурина, что, возможно, связано с нарушением активности ферментов цистеиндиоксигеназы и декарбоксилазы цистеинсульфиновой кислоты. В группе пациентов с дисфункцией эндотелия была выявлена отрицательная корреляция между ЭЗВД и уровнем аденозина (R= –0,32; p=0,03), что может указывать на то, что хроническое воздействие высоких концентраций аденозина может вызывать эндотелиальную дисфункцию [4, 7].
При более детальном рассмотрении показателей в зависимости от степени эндотелиальной дисфункции видно, что самый высокий уровень гипергомоцистеинемии (18,84 (16,820,5) мкмоль/л)) наблюдается в группе с резко выраженной дисфункцией эндотелия. Из данных, представленных в табл. 5.7 и 5.8, видно, что с увеличением уровня гомоцистеина происходит прогрессирующее ухудщение показателей эндотелийзависимой вазодилатации. В группе с резко выраженной ДЭ концентрация гомоцистеина более чем в полтора раза превышает уровень гомоцистеина в группе пациентов без ДЭ и более чем в 2,5 раза уровень гомоцистеина контрольной группы. Параллельно нарастанию уровня гомоцистеина на блюдается увеличение концентрации цистеина с его максимальным значением в группе пациентов с резко выраженной ДЭ.
Таблица 5.7 – Концентрации серосодержащих аминокислот у пациентов с подагрой с различной степенью дисфункции эндотелия (медиана (нижний квартиль – верхний квартиль)) и без нее.
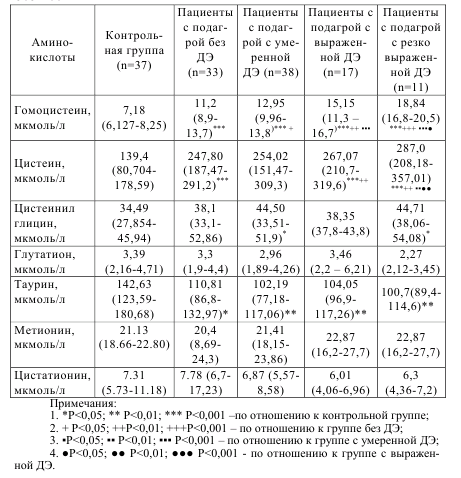
Необходимо отметить, что с возникновением эндотелиальной дисфункции наблюдается увеличение скорости распространения пульсовой волны, которое характеризует жесткость сосудистой стенки. Если в группе пациентов СРПВ была в пределах нормы, то с ухудшением параметров ЭЗВД она нарастает, что свидетельствует об увеличении жесткости сосудистой стенки.
Показатели метаболизма серосодержащих аминокислот, вазомоторной функции эндотелия плечевой артерии, скорости распространения пульсовой волны и уровень фолатов у пациентов с подагрой в сочетании с ишемической болезнью сердца и артериальной гипертензией
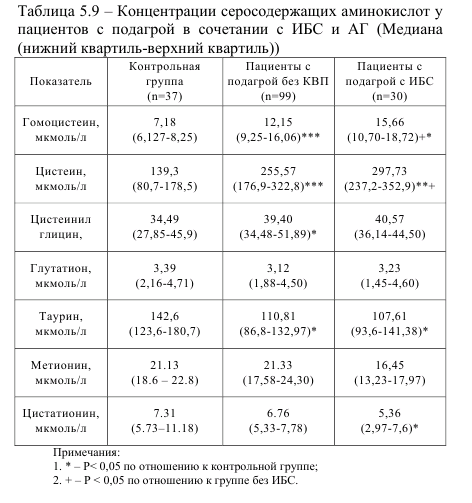
Ранее мы проводили анализ показателей у пациентов с подагрой без кардиоваскулярной патологии. С целью выяснения негативных факторов, которые доминируют у пациентов с подагрой в сочетании с ИБС, мы провели обследование данной группы пациентов. В исследование было включено 30 пациентов с подагрой в сочетании с ИБС: ССН ФК 2 и артериальной гипертензией 2-й степени, риск 4. Диагноз верифицировался с помощью холтеровского мониторирования или нагрузочной велоэргометрии (ВЭМ). В таблице 5.9 отражены показатели обмена серосодержащих аминокислот у пациентов с подагрой в сочетании с ИБС.
Как видно из представленных данных, концентрации гомоцистеина и цистеина в группе с ИБС более чем в два раза превышают концентрации данных аминокислот в контрольной группе и достоверно выше, чем в группе без ИБС. Концентрация таурина по сравнению с контрольной группой снижена и почти такая же, как и в группе без ИБС. Из данных, представленных в табл. 5.10, видно, что у пациентов с подагрой в сочетании с ИБС отмечается более выраженное нарушение ЭЗВД плечевой артерии в сравнении с группой пациентов без КВП, при отсутствии достоверных различий между этими двумя группами по показателям СРПВ, ЭНВД, уровней фолатов и холестерина. Вместе с тем, в сравнении с контрольной группой имеется ухудшение показателей СРПВ и сниженное содержание фолатов в плазме крови в группе пациентов с подагрой с ИБС. СРПВ характеризует жесткость артериальной стенки, ее повышение свидетельствует о процессах склерозирования стенки сосуда. Показатели ЭЗВД положительно коррелировали с уровнем фолатов (R=0,37; p=0,003) и обратно с уровнем гомоцистеина (R= -0,33; p=0,021) и мочевой кислоты (R= -0,19; p=0,03) [9].
Как видно из значений коэффициентов корреляций, уровни гомоцистеина и фолиевой кислоты оказывают более существенное влияние на функцию эндотелия, чем концентрация мочевой кислоты. Также выявлена значимая обратная корреляция ЭЗВД с концентрацией аденозина (R=-0,41; p=0,0017) [9].

Таким образом, у пациентов с подагрой в сочетании с ИБС и АГ отмечаются более высокие показатели гомоцистеина, цистеина и более выраженное нарушение ЭЗВД плечевой артерии и СРПВ на фоне гипофолатемии 5.3 Роль нагрузочного теста с метионином. Динамика изменения концентраций серосодержащих аминокислот у практически здоровых лиц и пациентов с подагрой без кардиоваскулярной патологии после нагрузочного теста с метионином Увеличение уровня гомоцистеина вследствие нагрузки метионином позволяет выявлять индивидуумов с повышенным риском сосудистых заболеваний [18]. Известно, что нагрузочный тест с метионином (НТМ) позволяет диагностировать нарушение реутилизации гомоцистеина, которое не выявляется стандартными методами клинического исследования. Это особенно важно, учитывая возможность алиментарной регуляции уровня гомоцистеина у лиц, имеющих обычно нормальные значения концентрации гомоцистеина плазмы крови, и у которых нагрузка метионином позволяет выявить нарушение процессов его утилизации (так называемая постнагрузочная гипергомоцистеинемия). Нагрузка метионином вызывает значительное повышение концентрации S–аденозилметионина [34], который снижает реметилирование гомоцистеина путем ингибирования метилентетрагидрофолатредуктазы и бетаин–гомоцистеин метилтрансферазы [20].
При низкой клеточной концентрации SAM снижается активность цистатионин–β–синтазы и, следовательно, снижается активность реакций транс– сульфурирования. И, наоборот, при высокой клеточной концентрации SAM происходит ингибирование синтеза 5– метилтетрагидрофолата и активация синтеза цистатионина и далее цистеина. Таким образом, нагрузка метионином может выявить дефект пути транс–сульфурирования гомоцистеина. На важность данной диагностической процедуры указывает то, что в одном исследовании из 429 обследованных человек у 15% была выявлена гипергомоцистеинемия натощак и еще у 18% после НТМ. Таким образом, в 55% из всех случаев гипергомоцистеинемии она была диагностирована только после НТМ [38]. В исследовании The NHLBI Family Heart Study было обследовано 274 человека и в 43% случаев гипергомоцистеинемия выявлена после нагрузки метионином [11]. Важность НТМ подтверждается также в данных, полученных в исследовании COMAC (European Concerted Action Project) [22]. Изучение уровня гомоцистеина после нагрузки метионином в группе людей с ранним атеросклерозом выявило гипергомоцистеинемию у 42% с цереброваскулярной болезнью, у 28% с облитерирующим эндартериитом, у 30% больных ИБС. Риск ИБС был в 24 раза выше, чем в группе контроля [15]. Для выявления скрытого нарушения обмена серосодержащих аминокислот и изучения особенностей их метаболизма у больных подагрой были проведены нагрузочные тесты с метионином у 40 пациентов с подагрой и у 20 практически здоровых лиц. Для выяснения механизмов нарушения серосодержащих аминокислот у больных подагрой и выявления взаимосвязи пуринового метаболизма и метаболизма серосодержащих аминокислот нами был выполнен нагрузочный тест с метионином, который позволяет диагностировать нарушение катаболизма гомоцистеина, не выявляемое стандартными методами клинического исследования. Также эта проба была выполнена для выявления взаимосвязи пуринового метаболизма и метаболизма серосодержащих аминокислот. Данные о содержании аминокислот представлены в таблицах 5.11 и 5.12.
Таблица 5.11 – Концентрация серосодержащих аминокислот до нагрузки метионином у здоровых лиц и пациентов с подагрой без КВП (Mедиана (нижний квартиль-верхний квартиль))
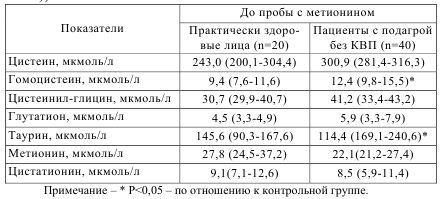

Как видно из представленных таблиц, исходно, до проведения нагрузочной пробы отмечался повышенный уровень гомоцистеина у больных подагрой (12,4 (9,8-15,5) мкмоль/л) в сравнении с контрольной группой (9,4 (7,6-11,6)мкмоль/л) (p<0,05). До проведения НТМ уровень гомоцистеина у 35,7% больных подагрой не превышал донагрузочный уровень гомоцистеина контрольной группы (9,4 мкмоль/л). После проведения нагрузочного теста уровень гомоцистеина был выше у всех больных подагрой по сравнению с постнагрузочным уровнем гомоцистеина контрольной группы, что может свидетельствовать о скрытом нарушении катаболизма гомоцистеина, которое выявляется только после нагрузочного теста [5, 6]. Концентрация таурина плазмы крови у больных подагрой после НТМ более чем в два раза превышала показатели в контрольной группе. Если в контрольной группе после НТМ наблюдалось снижение концентрации таурина на 43%, то у пациентов с подагрой концентрация таурина достоверно не изменилась, что может свидетельствовать о нарушении синтеза таурина из цистеина. Также после нагрузки было выявлено различие по концентрации цистеинил-глицина, которая после нагрузки была достоверно выше у больных подагрой (32,9 (28,9-37,3), у больных vs 23,8 (22,4-28,4) мкмоль/л в контрольной группе). При нагрузке метионином в контрольной группе на фоне увеличения уровня гомоцистеина наблюдается существенное снижение уровня цистеина, что согласуется с данными, полученными в другом исследовании [35]. В то же время у больных подагрой на фоне повышения концентрации гомоцистеина не наблюдалось достоверного снижения уровня цистеина [5, 6]. Таким образом, можно констатировать различие в метаболизме серосодержащих аминокислот между здоровыми и больными подагрой.
У здоровых лиц реутилизация гомоцистеина идет преимущественно по пути его реметилирования, о чем свидетельствует снижение концентраций цистеина и таурина, которые образуются в ходе реакций транссульфурирования. При дефиците фолата в плазме крови нарушается реметилирование гомоцистеина и он преимущественно реутилизируется по пути транссульфурирования, что и происходит у пациентов с подагрой. Если бы у пациентов сохранялась активность процессов реметилирования гомоцистеина, то после нагрузки метионином концентрация цистеина и таурина должна была бы снизиться, однако этого не произошло, концентрации цистеина и таурина практически не отличались до и после нагрузки.
Если нарушено реметилирование гомоцистеина, то после нагрузки ожидалось увеличение концентрации цистеина и таурина у пациентов, однако и этого не произошло, что свидетельствует о том, что путь транссульфурирования у них работает на пределе. У здоровых лиц эта нагрузочная проба показала большой функциональный резерв по реутилизации повышенной концентрации гомоцистеина, который отсутствует у пациентов с подагрой, что связано, возможно, с дефицитом фолиевой кислоты у них. Причина гипофолатемии у пациентов с подагрой связана, скорее всего, с увеличенным синтезом пуринов de novo, так как в структуру пуриновых оснований входят атомы углерода от 10-формил тетрагидрофолиевой кислоты. И вследствие усиления синтеза пуринов идет повышенный расход фолиевой кислоты, что, в свою очередь, приводит к нарушению обмена серосодержащих аминокислот. Таким образом, нарушение пуринового обмена у пациентов с подагрой приводит к нарушению обмена серосодержащих аминокислот.
Эффективность комбинированного применения функционально-связанных витаминов, аллопуринола и лозартана для коррекции дисфункции эндотелия и обмена серосодержащих аминокислот у пациентов с подагрой без кардиоваскулярной патологии и в сочетании с ИБС и АГ
В данном разделе приведены результаты собственных исследований эффективности коррекции эндотелиальной дисфункции путем применения монотерапии аллопуринолом, комплексной терапии с включением в схему лечения функционально связанных витаминов – B6 и фолиевой кислоты у следующих групп пациентов: пациентов c подагрой без КВП, пациентов с подагрой в сочетании с ИБС и АГ. В соответствии с задачами исследования изучена эффективность патогенетической терапии аллопуринолом, а также с дополнением функционально связанных витаминов (фолиевой кислоты и пиридоксина) у следующих групп пациентов: больных с подагрой без кардиоваскулярной патологии и с подагрой в сочетании с ИБС и АГ. Согласно протоколу исследования, первая группа пациентов с подагрой без КВП получала аллопуринол 300 мг в сутки, вторая группа с подагрой без КВП получала комбинированное лечение: аллопуринол 300 мг, фолиевую кислоту 0,3 мг, вит. В6 – 5 мг в сутки. Группа пациентов с подагрой в сочетании с ИБС и АГ получала аллопуринол 300 мг в сутки, фолиевую кислоту 0,5 мг, вит. В6 – 5 мг, лозартан 100 мг, метопролол 100 мг в сутки. По требованию пациенты с ИБС принимали нитраты. Необходимость включения лозартана вызвана тем, что у пациентов с подагрой в сочетании с ИБС имелась и артериальная гипертензия. Кроме того, лозартан является единственным антигипертензивным препаратом, который обладает урикозурическим эффектом. В исследование были включены пациенты с ИБС: стабильная стенокардия напряжения, ФК II и артериальной гипертензией не выше 2-й степени. Лечение проводилось в течение 30 дней, после чего проводилось повторное определение функциональных и биохимических показателей.
Влияние терапии аллопуринолом на функцию эндотелия и обмен серосодержащих аминокислот у пациентов с подагрой без кардиоваскулярной патологии
Из данных, представленных в таблице 5.13, видно, что на фоне терапии аллопуринолом не наблюдалось положительных сдвигов в метаболизме серосодержащих аминокислот. Достоверного уменьшения концентрации гомоцистеина, цистеина и других аминокислот не наблюдалось. Однако после лечения аллопуринолом наблюдалось улучшение эндотелийзависимого ответа, который не достиг показателей контрольной группы и составил 55% от значения последнего (таблица 5.14).
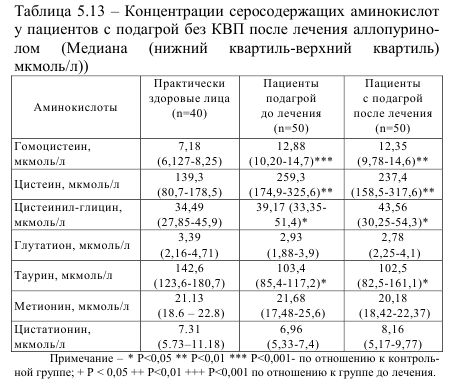

Улучшение показателей ЭЗВД после лечения аллопуринолом связано с его способностью блокировать фермент ксантиноксидазу, при участии которой генерируются кислородные радикалы. Не отмечено изменений в СРПВ после проведенного лечения аллопуринолом. Значения ЭНЗВД и общего холестерина у больных не отличались от параметров практически здоровых лиц ни до, ни после лечения (таблица 5.14). После лечения аллопуринолом не наблюдалось увеличения уровня фолиевой кислоты, также не отмечено и положительных сдвигов в метаболизме серосодержащих аминокислот, так как фолиевая кислота играет важную в роль в реутилизации гомоцистеина [4].
Влияние комплексной терапии аллопуринолом и функционально связанными витаминами на параметры вазомоторной функции эндотелия плечевой артерии функцию эндотелия и аминокислотный обмен у пациентов с подагрой без кардиоваскулярной патологии
Из данных, представленных в таблице 5.15, видно, что на фоне увеличения уровня фолиевой кислоты наблюдается улучшение обмена серосодержащих аминокислот, что проявляется в снижении концентрации гомоцистеина, цистеина и цистеинилглицина, и более выраженное улучшение эндотелийзависимой вазодилатации (таблица 5.16) в сравнении с показателями первой группы [4]. Однако, несмотря на комлексную терапию в течение 30 дней, показатели ЭЗВД и концентрация гомоцистеина во второй группе не достигли значений практически здоровых лиц, что свидетельствует о необходимости более длительного назначения данной комбинации препаратов.
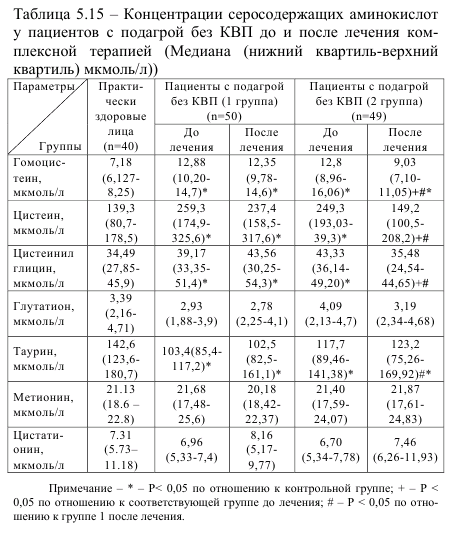

Влияние комплексной терапии аллопуринолом, функционально связанными витаминами и лозартаном на показатели метаболизма серосодержащих аминокислот, уровень фолатов, функциональное состояние эндотелия плечевой артерии и скорость распространения пульсовой волны у пациентов с подагрой в сочетании с ИБС и АГ
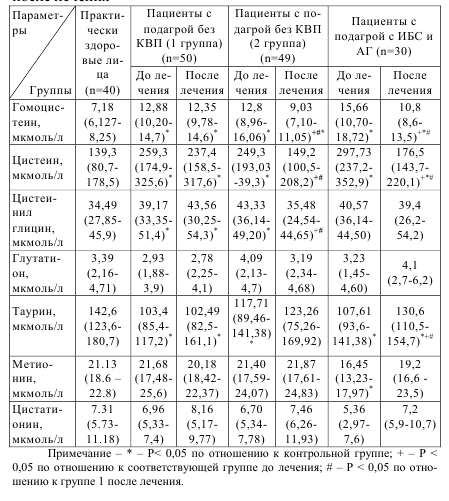
При анализе изменений, представленных в таблице 5.17 в концентрациях серосодержащих аминокислот после проведенного лечения видно, что различия в концентрациях гомоцистеина и цистеина сохранились. Они были выше, чем в контрольной и второй группе и ниже, чем в первой группе больных, которые принимали аллопуринол. Хотя после лечения уровень гомоцистеина и не достиг значений контрольной и второй групп, однако в группе больных подагрой с ИБС и АГ наблюдалось более выраженное снижение его уровня – на 31%, в то время как во второй группе снизился на 26% и практически не изменился в первой группе. Это свидетельствует о более успешном корригирующем действии сочетанной терапии с учетом влияния на максимально возможное число патологических звеньев.
Таблица 5.17 – Концентрации серосодержащих аминокислот у больных подагрой в сочетании с ИБС и АГ (Mедиана (нижний квартиль-верхний квартиль) мкмоль/л)) и без ИБС и АГ после лечения.
Как видно из данных, представленных в таблице 5.18, на фоне фармакотерапии наблюдалось более выраженное улучшение ЭЗВД в группе пациентов с подагрой в сочетании с ИБС и АГ – на 18,6%, в то время как прирост в первой группе составил 12,35%, а во второй 18,2 [9].
Таблица 5.18 – Показатели состояния функции эндотелия и концентрация фолатов в плазме крови у больных подагрой с ИБС (медиана (нижний квартиль – верхний квартиль)) после лечения.
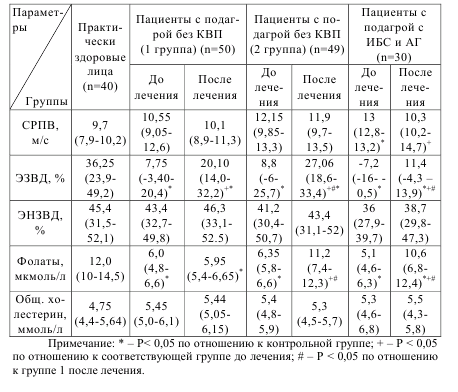
Кроме того, на фоне комплексной терапии у 22 пациентов с подагрой в сочетании с ИБС и АГ удалось достичь целевого уровня АД. В целом на фоне лечения в группе пациентов с ИБС и АГ наблюдалась динамика к снижению артериального давления – 165/95 (145-176/90-97) мм рт. ст. до лечения и 140/85 (125-150/80-85) мм рт. ст. после лечения [9].
Заключение
1. У пациентов с подагрой без кардиоваскулярной патологии отмечено нарушение метаболизма серосодержащих аминокислот, которое в сравнении с контрольной группой характеризуется увеличением концентраций гомоцистеина (на 41%, p<0,05), цистеина (на 45,71%, p<0,05), цистеинилглицина (p<0,05), снижением уровня таурина (на 22,6%, p<0,05) и фолатов в плазме крови (на 50,84%, p<0,05) . У пациентов с подагрой в сочетании с ИБС стенокардией напряжения ФК II и АГ II ст., риск 4, по сравнению с пациентами без кардиоваскулярной патологии выявлено более выраженное нарушение обмена серосодержащих аминокислот, что проявляется увеличением уровней гомоцистеина (на 28,9%, p<0,05), цистеина (на 16,4%, p<0,05)) и снижением фолатов в плазме крови.
2. У пациентов с подагрой без кардиоваскулярной патологии при нормальных показателях эндотелийнезависимой вазодилатации и скорости распространения пульсовой волны выявлено нарушение эндотелийзависимой вазодилатации плечевой артерии. У пациентов с подагрой в сочетании с ИБС стенокардией напряжения ФК II и АГ II ст., риск 4, определено более выраженное нарушение ЭЗВД плечевой артерии (на 15,7% ниже в сравнении с группой без кардиоваскулярной патологии и на 43,45% в сравнении с контрольной группой, p<0,05), а также увеличение ее жесткости (увеличение СРПВ на 36,7% в сравнении со здоровыми). Установлено, что повышение концентрации гомоцистеина, цистеина и снижение фолатов у пациентов с подагрой сопровождается нарушением эндотелийзависимой вазодилатации плечевой артерии, что подтверждается отрицательной корреляцией между ЭЗВД и уровнем гомоцистеина (R= -0,49; p=0,00001), ЭЗВД и уровнем цистеина (R= -0,22, p=0,03), (наличие отрицательной корреляции между уровнем цистеина и ЭЗВД у больных подагрой нами выявлено впервые.
3. Снижение концентрации фолиевой кислоты в плазме крови у пациентов с подагрой (5,90 (5,30 – 6,60) мкмоль/л у больных в сравнении с 12,0 (10 – 14,5) мкмоль у здоровых) является ключевым звеном в изменении обмена серосодержащих аминокислот, что сопровождается нарушением процессов реметилирования гомоцистеина и повышением его концентрации. Это подтверждается отрицательной корреляцией между уровнем фолатов и гомоцистеина (R= -40,4; p=0,00152). Данная корреляция у пациентов с подагрой выявлена впервые. Положительная корреляция между фолиевой кислотой и ЭЗВД (R=0,47; p=0,04) в группе пациентов с ДЭ свидетельствует о влиянии её на функцию сосудистого эндотелия. Следовательно, гипофолатемия может являться пусковым фактором развития нарушения обмена серосодержащих аминокислот и нарушения вазомоторной функции эндотелия у пациентов с подагрой.
4. Нагрузочная проба с метионином позволяет определить различие в метаболизме серосодержащих аминокислот у практически здоровых лиц и пациентов с подагрой, что обусловливает назначение фолиевой кислоты и пиридоксина у последних. Выявлено, что у практически здоровых лиц происходит реутилизация гомоцистеина главным образом путем реметилирования. У пациентов же с подагрой преобладают процессы транссульфурирования гомоцистеина вследствие дефицита фолиевой кислоты и снижения активности реакций реметилирования. Кроме того, нагрузочная проба с метионином позволяет у пациентов с подагрой выявить скрытое нарушение реутилизации гомоцистеина, которое имеется у 35% пациентов.
5. Применение аллопуринола в суточной дозе 300 мг в течение 30 дней в группе пациентов с подагрой без кардиоваскулярной патологии не влияет на метаболизм серосодержащих аминокислот (концентрации их остались практически без существенных изменений, p>0,05). Комплексная терапия, включающая аллопуринол 300 мг, фолиевую кислоту – 0,3 мг, пиридоксин 5 мг в группе пациентов с подагрой без кардиоваскулярной патологии приводит к уменьшению уровня гомоцистеина (на 29,46%, p<0,05), цистеина (40,16%, p<0,05), цистенилглицина (p<0,05) и увеличению фолатов в плазме крови (с 6,35 до 11,2 мкмоль/л, p<0,05). В обеих группах пациентов отмечено улучшение ЭЗВД плечевой артерии с более выраженным улучшением в группе пациентов на фоне комплексной терапии (на 18,2% на фоне комплексной терапии и на 12,35% на фоне аллопуринола, p<0,05).
6. Комплексная терапия у пациентов с подагрой в сочетании с ИБС стенокардией напряжения ФК II и АГ 2-й степени, риском 4, включающая аллопуринол 300 мг в сутки, фолаты 0,5 мг, пиридоксин 5 мг, метопролол 100 мг и лозартан 100 мг в сутки в течение 30 дней, приводит к более выраженному снижению гомоцистеина (на 31,1%, p<0,05), цистеина (на 40,9%, p<0,05), увеличению таурина (p<0,05), увеличению ЭЗВД плечевой артерии (на 18,6%, p<0,05) и уменьшения скорости распространения пульсовой волны (с 13 до 10,3 м/с, p<0,05).
7. У пациентов с подагрой как без кардиоваскулярной патологии, так и в сочетании с ИБС и АГ, определены возможности дифференцированного назначения монотерапии аллопуринолом, комплексной терапии, включающей аллопуринол, фолаты, пиридоксин, а также метопролол и лозартан в зависимости от нарушения метаболизма серосодержащих аминокислот, уровня фолатов в плазме крови и функционального состояния эндотелия плечевой артерии. Установлено, что у больных подагрой без кардиоваскулярной патологии эффективной схемой лечения является комбинация: аллопуринол 300 мг, фолиевая кислота – 0,3 мг и пиридоксин 5 мг. У пациентов с подагрой в сочетании с ИБС и АГ эффективной схемой лечения является назначение аллопуринола 300 мг, фолиевой кислоты 0,5 мг, пиридоксина 5 мг, метопролола 100 мг и лозартана 100 мг.