Среди причин перинатальной смертности в Республике Беларусь врожденные пороки развития (ВПР) плода занимают ведущие позиции, пропуская вперед лишь внутриутробные инфекции и состояния, характерные для перинатального периода [1]. Встречаемость врожденных аномалий развития у плода не имеет тенденции к снижению, что характерно не только для Беларуси, но и для России [2]. Интерес к изучению роли гомоцистеина в генезе пороков развития плода связан с трудностями ранней диагностики данных состояний, необходимостью выяснения этиологии возникающих нарушений, поиска эффективных методов профилактики ввиду значительных экономических затрат на лечение детей с врожденными аномалиями. В настоящее время основным методом диагностики врожденных пороков развития плода является ультразвуковое исследование, определенными преимуществами которого являются доступность, быстрота выполнения и отсутствие доказанных фактов вредного воздействия на плод. Однако, несмотря на все достоинства, возможности эхографии ограничены, что связано с наличием сопутствующего маловодия, выраженной угрозы прерывания беременности, «неудобного» для исследователя положение плода, избыточной массой тела пациенток, поздней манифестацией отдельных аномалий [3].
Значительную роль играют качество используемой аппаратуры и опыт исследователя [4, 5]. И хотя в Республике Беларусь ежегодно прерывается около 500-600 беременностей с некурабельными пороками, врожденные аномалии развития плода сохраняют лидирующее положение не только в структуре перинатальной и младенческой смертности, но и, что особенно важно, в структуре первичной детской инвалидности. Незначительное место в выявлении врожденных аномалий занимают инвазивные методы диагностики, к которым относятся амниоцентез, биопсия ворсин хориона, кордоцентез. Однако эти методы способствуют выявлению лишь хромосомных аномалий, удельный вес которых в структуре всех пороков развития невелик [6]. Чаще всего в патологический процесс вовлечены гены, а не хромосомы. Установлено, что риск возникновения пороков развития плода повышается при увеличении возраста родителей, наличии отягощенной наследственности, неполноценном питании, метаболических нарушениях (сахарный диабет), воздействии тератогенов, медикаментов и т.д. [7].
К сожалению, механизмы повреждения генетического аппарата начали изучаться сравнительно недавно, и поэтому биохимические основы воздействия неблагоприятных факторов, приводящие к изменению функционирования клетки, требуют тщательного рассмотрения. Диагностика врожденных пороков развития с помощью биохимических методов практически не применяется в повседневной работе акушеров-гинекологов и генетиков. Исключением может служить лишь определение уровня αфетопротеина, β-субъединицы хорионического гонадотропина и плазменного протеина А, ассоциированного с беременностью (РАРР-А) для диагностики определенного круга аномалий. Разработанные биохимические методы для выявления генных аномалий (болезнь Тея-Сакса, мукополисахаридозы, патология системы гемостаза и пр.) используются лишь при обоснованном подозрении на возможное возникновение этих состояний с учетом данных об отягощенной наследственности либо уже наличия случая рождения в семье ребенка с подобной патологией. Проведение диагностики этих заболеваний является довольно дорогостоящей процедурой и в качестве скрининга не приемлема даже для экономически высоко развитых стран. Тем не менее, скрининг необходим, поскольку, несмотря на наличие факторов риска, в отношении которых доказана неблагоприятная роль в формировании врожденных пороков развития плода, пороки возникают, к сожалению, у молодых женщин с неотягощенной наследственностью, без наличия метаболических нарушений и в отсутствие действия тератогенов.
Отмечено, что при последующих беременностях у этих пациенток повторения возникновения врожденных аномалий плода не происходит. Видимо, существует иной механизм формирования пороков развития, не имеющий в основе морфологическое повреждение хромосомного аппарата клетки. Это еще раз свидетельствует о необходимости изучения биохимических механизмов, приводящих к формированию ВПР, и факторов, способствующих выявлению нарушенного клеточного метаболизма. Следует отметить также, что воспитание и содержание ребенка, родившегося с пороком развития, требует значительных финансовых затрат. Профилактические мероприятия обходятся обществу дешевле, нежели медицинская помощь, реабилитация, социальные выплаты для такого ребенка. К примеру, экономическая эффективность профилактики синдрома Дауна может достигать 100кратного уровня по сравнению с расходами на содержание и лечение таких детей [6].
Все применяемые в настоящее время методы диагностики врожденных аномалий являются «констатирующими» и носят характер вторичной профилактики, направленной исключительно на выявление и элиминацию некурабельных пороков развития, либо последующую хирургическую коррекцию. Изучение биохимических основ предполагает принципиально иной подход к проблеме возникновения ВПР, поскольку выяснение и коррекция биохимических нарушений, приводящих к формированию врожденных аномалий, может носить характер первичной профилактики. В настоящее время интенсивно изучается связь между гипергомоцистеинемией и возникновением пороков развития у плода. Была доказана способность фолатов оказывать протективный эффект в отношении возникновения пороков нервной трубки [8, 9]. Интересно, что первые косвенные литературные данные по этому вопросу относятся к 18 веку, когда датская акушерка в своих записях отметила увеличение количества детей с пороками центральной нервной системы после неурожайных годов [10] и преобладание этой патологии в среде беднейших слоёв населения. Подобные проявления часто являются следствием природных катаклизмов и войн [11]. Наибольшее внимание исследователей уделяется порокам формирования нервной трубки (spina bifida, анэнцефалия) ввиду огромной социальной значимости.
Считается, что формирование пороков нервной трубки зависит от сочетанного воздействия факторов окружающей среды и генетической предрасположенности. Отмечается, что ведущим патогенетическим звеном в формировании данного вида аномалий служит дефицит фолиевой кислоты и/или витамина В12 [12]. Owen et al (2000), проанализировав данные о пороках развития обсуждаемой группы, показали, что риск их формирования выше у матерей-подростков и у женщин с тремя и более беременностями в анамнезе. Первый факт объясняется дефицитом фолатов во время интенсивного роста подросткового организма, второй – дефицитом фолатов в результате повторных беременностей [13]. Помимо недостатка фолиевой кислоты, немаловажное значение имеет витамин В12, поскольку существуют литературные данные, доказывающие связь дефицита этого витамина с пороками нервной трубки [14]. Достаточные количества В12 вместе с фолиевой кислотой играют важную роль в стабильности генома [15]. Серьезное значение, по мнению ряда исследователей [16, 17, 18], имеют нарушения ферментных систем, участвующих в метаболизме гомоцистеина и фолиевой кислоты. Наиболее изученным примером является полиморфизм гена MTHFR (С677→Т), катализирующего реакцию превращения 5,10-метилентетрагидрофолата в 5-метилтетрагидрофолат. Изучение мутаций в других ферментах, принимающих участие в реметилировании гомоцистеина [19, 20, 21], не привело к установлению их роли в генезе пороков нервной трубки.
Имеет значение накопление SAH в клетке и подавление трансметилирования в процессе нейруляции [8, 9, 12]. Дефекты замыкания нервной трубки при анэнцефалии или spina bifida связаны с нарушением миграции клеток эпителия под воздействием гомоцистеина в условиях дефицита кобаламина [22] и/или фолиевой кислоты, что может усугубляться на фоне полиморфизма гена MTHFR [9], а также возможным ингибирующим действием гомоцистеина на актиновые миофиламенты [23]. Оксидативный стресс, дефицит селена и нарушение биодоступности оксида азота также могут, по мнению некоторых авторов, играть роль в возникновении пороков нервной трубки [24]. Показано, что ингибирование NOсинтазы приводит к снижению активности метионин синтазы, ответственной за реметилирование гомоцистеина [25]. Нарушение продукции оксида азота ведет также к неадекватной васкуляризации экстраэмбриональных структур, ответственных за трофику эмбриона на ранних стадиях развития, в частности, имеет место подавление сосудистого эндотелиального фактора роста – vascular endothelial growth factor (VEGF) [26]. Учитывая важную роль фолиевой кислоты в обмене гомоцистеина, была разработана стратегия насыщения продуктов питания, главным образом, зерновых, фолатами. Известно, что фолиевая кислота быстро разрушается при хранении и кулинарной обработке, а из поливитаминных препаратов и обогащенных продуктов гораздо легче попадает в организм [8]. В США в 1993 году было принято постановление правительства (действует с 1998 года) о насыщении злаковых продуктов фолиевой кислотой [8].
Результаты исследований свидетельствуют об увеличении содержания фолатов в плазме крови и эритроцитах при одновременном снижении уровня гомоцистеина и метилмалоновой кислоты среди всех обследованных возрастных категорий [27]. По данным других авторов, отмечаемое повышение содержания в крови витаминов группы «В» привело к снижению частоты встречаемости пороков нервной трубки с 4,67 в 1992-1996 гг. дo 1,01 в 1998-2002 гг. на 1000 живорожденных [28]. Происхождение врожденных пороков сердца (ВПС) имеет мультифакториальную природу, причем одним из факторов может являться нарушение обмена гомоцистеина. Ряд исследователей связывают патогенез врожденных пороков сердца с нарушением процесса реметилирования гомоцистеина [29, 30, 31]. Тем не менее, в крупном исследовании, изучавшем полиморфизм 32 генов, участвующих в метаболизме гомоцистеина и других патофизиологических процессах (коагуляция, межклеточное взаимодействие, воспалительный ответ и регуляция артериального давления), не выявлено ассоциации полиморфизма MTHFR с пороками сердца [32]. Нарушения процессов транссульфурирования (обычно приводящие к тяжелым формам гипергомоцистеинемии) также могут иметь место при формировании пороков сердца, что находит свое отражение в литературных источниках [33].
Известно, что уровень гомоцистеина в плазме крови повышен при синдроме Дауна [34, 35, 36]. Неадекватное метилирование ДНК приводит к нарушению сегрегации хромосом во время мейоза. James et al. (1999) в своей работе установили, что большинство случаев рождения детей с синдромом Дауна произошло у женщин моложе 30 лет, хотя именно увеличение возраста является общеизвестным фактором риска хромосомных аномалий. Более того, авторы отметили, что наличие у этих женщин мутации MTHFR С677→Т повышает риск рождения ребенка с синдромом Дауна в 2,6 раза [37]. Интересные данные в отношении дефицита фолатов приведены в работе японских авторов [38]. Япония считается благополучной страной в отношении обеспеченности витаминами, но так называемая «вестернизация» образа жизни, в том числе и в вопросах питания, привела к увеличению частоты встречаемости синдрома Дауна. Авторы связывают это с повышенным уровнем гомоцистеина в плазме крови обследованных ими женщин (39). Нарушение обмена гомоцистеина при синдроме Дауна (трисомия 21) проявляется в том, что ген цистатионин-βсинтазы – фермента, катализирующего первый и необратимый шаг транссульфурирования (конденсация гомоцистеина с серином), находится именно на 21 хромосоме. При синдроме Дауна имеет место гиперэкспрессия этого гена, приводящая к избыточной активности транссульфурирования [35, 40].
Поскольку подавляющее количество образующегося гомоцистеина идет на наработку цистеина и имеет место некоторое функциональное угнетение процесса реметилирования [40, 41, 42], возникают два патогенных фактора – недостаток метионина и связанного с этим SAM, и избыток цистеина, что чрезвычайно неблагоприятно для клетки [43]. В последние годы появились работы, в которых возникновение расщелин верхней губы и твердого неба также связывают с дефицитом фолатов или с полиморфизмом генов фолатного обмена [44, 45]. Если допустить, что причиной формирования пороков нервной трубки и ВПС является недостаток витаминов группы «В», то остается непонятным, почему нет сочетания, к примеру, спинномозговой грыжи с «заячьей» губой. Эти состояния практически всегда встречаются изолированно друг от друга. Анэнцефалия сочетается с расщелиной верхней губы только в 2% (!) случаев [3]. Имеются указания на связь изменений в транспортном белке транскобаламине с формированием расщелин лица [46]. Не исключается и роль курения в сочетании с дефицитом фолиевой кислоты в генезе расщелин лица, поскольку оба этих фактора приводят к гипергомоцистеинемии, которая, в свою очередь, влияет на активность NO-синтазы. Было установлено, что полиморфизм гена NO-синтазы в сочетании с курением и дефицитом фолатов, приводит к повышенному риску рождения ребенка с изолированной расщелиной верхней губы [47].
Кроме того, по мнению Weingaertner et al., возможной причиной расщелин лица, помимо известных факторов, может быть субклинический дефицит витамина В6. [48]. Основные В6-зависимые ферменты транссульфурирования (цистатионин-β-синтаза и цистатионин-γ-лиаза) также, вероятно, играют роль в генезе расщелин лица, причем в указанной работе делается акцент на полиморфизм этого гена, полученного плодом от матери, но не от отца. В этом случае риск дефектов лица повышается в 18,7 раза [49]. Литературные данные свидетельствуют о том, что в этой ситуации может иметь место нарушение метилирования при импринтинге, когда одна из аллелей полностью деметилируется и затем метилируется de novo [50]. Это подчеркивает важность обеспеченности витаминами В6, В9 и В12 для процессов метилирования во время эмбриогенеза. Кроме того, инициируемый гомоцистеином и ионами меди, апоптоз играет неблагоприятную роль в процессе слияния твердого неба [51]. Этиология скелетных дисплазий в большинстве случаев остается неизвестной [3]. Считается, что причиной подобных пороков могут быть хромосомные аномалии, генные мутации, воздействие тератогенов, синдром амниотических перетяжек. Имеется несколько работ, посвященных изучению нарушений обмена гомоцистеина при патологии скелета.
В частности, сообщается о гипергомоцистеинемии при терминальных дефектах конечностей [52, 53] и изолированной косолапости [54]. В любом случае, требуется дальнейшее углубленное изучение патогенеза этого вида аномалий, в частности, влияние мутаций в различных генах, ответственных за метаболизм гомоцистеина и межклеточные взаимодействия во время эмбрионального развития [55]. Однако данные о значении повышенного уровня гомоцистеина (гипергомоцистеинемия) в генезе врожденных аномалий весьма противоречивы. Следует отметить, что практически отсутствуют сведения о роли его в возникновении диафрагмальных грыж, атрезий желудочно-кишечного тракта (атрезия пищевода, атрезия двенадцатиперстной кишки, атрезия ануса), поликистоза почек, шейных гигром, множественных врожденных аномалий. Несмотря на относительно редкую встречаемость, пациенты с диафрагмальной грыжей, атрезией пищевода или различными видами врожденной кишечной непроходимости требуют неоднократных хирургических вмешательств, длительного парентерального питания в послеоперационном периоде, а также повторных курсов реабилитационных мероприятий, что, однако, не всегда приводит к желаемому эффекту и выздоровлению этих детей [56]. Среди причин хронической почечной недостаточности у детей с необходимостью проведения гемодиализа ведущие позиции занимают врожденные пороки мочевыделительной системы [57]. Поэтому изучение этиологии и патогенеза подобных аномалий очень важно и с экономической точки зрения.
В литературных источниках также практически отсутствуют работы, касающиеся определения уровня гомоцистеина в околоплодных водах. К примеру, приводятся данные об уровне гомоцистеина в околоплодных водах при нормально протекающей беременности [44]. Имеются экспериментальные данные о повышенном уровне гомоцистеина и снижении уровня витамина В12 в околоплодных водах при расщелинах твердого неба [58]. Кроме того, проведены интересные исследования по изучению содержания гомоцистеина в околоплодных водах при пороках нервной трубки в зависимости от наличия полиморфизма гена MTHFR у матерей и плодов [59]. В соответствии с концепцией Van-Allen [8] нервная трубка первоначально замыкается в 5 различных точках и лишь затем сливается в единое целое (процесс нейруляции). Авторы установили, что повышенный уровень гомоцистеина в околоплодных водах в сочетании с полиморфизмом гена MTHFR С677→Т ассоциируется с нарушением замыкания нервной трубки в затылочной и люмбосакральной области. Учитывая то, что имеет место интенсивный обмен между плодом и окружающей его средой, изучение концентрации гомоцистеина в амниотической жидкости также представляется интересным направлением диагностики.
Материал и методы исследования
Проведено обследование 174 беременных женщин, которые были разделены на 3 группы: одну основную и две группы сравнения. Основную группу сформировали 104 пациентки, у которых при ультразвуковом исследовании или при использовании инвазивных методов пренатальной диагностики (амниоцентез, биопсия ворсин хориона) были выявлены врожденные пороки развития плода. Наличие пороков развития подтверждалось при патологоанатомическом исследовании в случае прерывания беременности по медикогенетическим показаниям в сроке 15-28 недель беременности либо при рождении плода с пороками развития и последующей верификацией диагноза различными клиниколабораторными или инструментальными методами. Все обследованные женщины основной группы были разделены на подгруппы в зависимости от вида пороков развития у плода. У беременных основной группы исследовали кровь (плазму и отмытые эритроциты) и околоплодные воды.
Группу сравнения составили 70 женщин, которые были разделены на 2 подгруппы. В первую подгруппу (группа сравнения «А») вошли 52 пациентки, которые родили живых доношенных детей без каких-либо отклонений в развитии (у этих беременных исследовали плазму крови и отмытые эритроциты). У этих женщин не наблюдалось осложнений гестационного процесса, с которыми может быть ассоциирована гипергомоцистеинемия (гипертензивные расстройства, задержка внутриутробного развития плода, тромбофилические осложнения), вплоть до конца беременности и родов, что и явилось основанием для включения их в группу сравнения. Вторую подгруппу (группа сравнения «В») составили 18 пациенток, беременность у которых была прервана по немедицинским показаниям в сроке беременности 15-21 неделя, причем при патологоанатомическом исследовании абортусов врожденных аномалий развития выявлено не было. У пациенток данной подгруппы во время процедуры прерывания беременности были получены околоплодные воды, проводилось исследование их состава и сравнение его с составом околоплодных вод у пациенток основной группы в сопоставимые сроки беременности.
У всех беременных осуществлено стандартное общеклиническое обследование, ультразвуковое исследование для оценки анатомии плода, а также специальное исследование плазмы крови, отмытых эритроцитов и околоплодных вод методом высокоэффективной жидкостной хроматографии (HPLC – high-performance liquid chromatography) с изучением уровней гомоцистеина, цистеина и глутатиона в указанных биологических субстратах. Показатели изучаемых метаболитов у пациенток основной группы анализировались в зависимости от вида врожденной аномалии у плода. У всех обследованных пациенток кровь в количестве 5 мл забиралась из локтевой вены натощак, помещалась в пробирки с гепарином и немедленно центрифугировалась в течение 5 минут с частотой оборотов 2000 в минуту. После центрифугирования плазму крови отбирали автоматической пипеткой в количестве 1 мл, отмытые эритроциты получали по стандартной методике [62]. Полученный материал помещали в пробирки, замораживали при температуре -78ºС и хранили до момента проведения исследования в холодильной камере.
Околоплодные воды были получены при трансцервикальном амниоцентезе, который осуществляли на первом этапе прерывания беременности перед интраамниальным введением гипертонического раствора хлорида натрия, под ультразвуковым контролем (рисунок 7.1.). Полученная амниотическая жидкость подвергалась центрифугированию в течение 5 минут с частотой оборотов 2000 в минуту, после чего замораживалась и хранилась в таких же условиях, как плазма крови и отмытые эритроциты.
В день проведения анализа образцы плазмы или околоплодных вод размораживали при комнатной температуре. 50 мкл плазмы или околоплодных вод смешивали с 5 мкл раствора TCEP (tris(2-carboxylethyl)phosphine) (100 мг/мл), после чего оставляли при комнатной температуре на 30 минут. Затем осаждали белки путем добавления 50 мкл 10% раствора ТХУ (трихлоруксусная кислота) и центрифугировали при 4ºС в течение 15 минут при 16000 оборотах в минуту на центрифуге «Biofuge» фирмы «Heraeus» (США). В микропробирку объемом 200 мкл, содержащую 2 мкл 1,55 М NaOH, 12,5 мкл 0,125 М Na-боратного буфера с 200 мг/л ЭДТА, pH 9,5, и 5 мкл раствора SBD-F (ammonium 7-fluorobenzo-2-oxa1,3-diazole-4-sulfonate) (1 мг/мл) в аналогичном буфере, вносили 10 мкл супернатанта и инкубировали 1 час при 60°С [63]. После охлаждения при комнатной температуре в систему вводили 5 мкл реакционной смеси.
Отмытые эритроциты размораживали при комнатной температуре, добавляли к ним равный объем воды и гомогенизировали. 50 мкл полученного гомогената смешивали с 5 мкл раствора TCEP (tris(2-carboxylethyl)phosphine) (100 мг/мл), после чего оставляли при комнатной температуре на 30 минут. Дальнейшее приготовление образцов отмытых эритроцитов для проведения хроматографических исследований было аналогичным приготовлению образцов плазмы и околоплодных вод. Разделение осуществляли на колонке Диасорб 130 С16Т, 3х250 мм, 7 мкм. Подвижная фаза: 0,1 М NaH2PO4, 17 мМ CH3COOH, pH 3,65, 40 мг/л ЭДТА, 3% ацетонитрила. Скорость потока составляла 0,6 мл/мин, температура колонки 30°С. Детектирование осуществлялось по флуоресценции, 379/510 нм. Определения проводили на хроматографической системе Agilent 1100, содержащей 4-канальный градиентный насос, термостат колонок, автосамплер и детектор флуоресценции. Регистрация хроматограмм и их количественная обработка осуществлялись с помощью Agilent ChemStation A10.01. На рисунке 7.2. представлена хроматограмма, полученная при исследовании плазмы крови. Пример изображения хроматограммы, полученной при изучении плазмы крови с совмещенной хроматограммой стандарта, приведен на рисунке 7.3.
Образцы анализировали сериями по 24, каждая серия включала смесь стандартов определяемых соединений (100 мкмоль/л) для контроля калибровочных кривых. Статистическая обработка данных осуществлена методами непараметрической статистики ввиду отсутствия в группах нормального распределения признаков. Для сравнения групп применялся U-критерий Манна-Уитни (MannWhitney). Данные представлялись в виде Me (медиана значений) и интерквартильного размаха с описанием значения 25 и 75 процентилей. При проведении корреляционного анализа применялся критерий R Спирмена (Spearman). При использовании любого теста или критерия рассчитывалась вероятность справедливости нулевой гипотезы (отсутствие различий групп) – р. Статистически значимыми различия считались при p < 0,05. Значения р приводятся с точностью до трех десятичных знаков, за исключением, когда p < 0,001 [60, 61]. Статистический анализ полученных результатов проведен с помощью пакета прикладных программ STATISTICA 6.0 и Microsoft Excel.
Результаты и обсуждение
Пациентки основной группы и группы сравнения «А» не различались между собой по возрасту, массо-ростовым показателям, данным акушерско-гинекологического анамнеза (время наступления менархе, начало половой жизни, количество беременностей в анамнезе и их исходы, гинекологическая заболеваемость). Из лабораторных данных необходимо указать на статистически значимое различие в уровне гемоглобина в периферической крови у женщин основной группы и группы сравнения – 119 (113-128) г/л и 129 (119-134) г/л, соответственно (р<0,001). И хотя данные значения находятся в пределах нормы, и вряд ли имеют клиническое значение, все же можно косвенно предполагать скрытый дефицит фолатов, необходимых также и для процессов гематопоэза, у пациенток основной группы. Не было отмечено различий и в частоте встречаемости различной соматической патологии. Стоит лишь отметить, что среди беременных женщин основной группы гораздо чаще имелись указания на перенесенный гепатит, хотя эти различия и не были статистически значимыми. Поскольку печень играет важную роль в метаболизме гомоцистеина, а также в синтезе глутатиона, возможно, эти анамнестические данные могут в определенной степени свидетельствовать о снижении функциональной способности печени. Течение беременности также не имело различий среди беременных основной группы и группы сравнения. Все беременные группы сравнения «А» родили в срок живых детей, масса тела новорожденных составила 3450 (3175-3650) г, длина тела 53 (52-54) см. Случаев рождения детей с дефицитом массы тела у женщин группы сравнения не отмечено. Учитывая то, что определенная часть врожденных аномалий может не выявляться в период новорожденности, мы проследили катамнез родившихся детей в течение 6 месяцев – ни в одном из наблюдений пороков развития плода не было выявлено. Анамнестические, антропометрические и клиниколабораторные данные пациенток группы сравнения «В» не отличались от показателей среди пациенток группы сравнения «А».
Содержание гомоцистеина в плазме крови
Уровень общего гомоцистеина (tHcy) в плазме крови беременных обеих групп представлен в таблице 7.1 (указаны медиана значений, 25 и 75 процентили, критерий р МаннаУитни).
Таблица 7.1 – Уровень общего гомоцистеина в плазме крови беременных женщин основной группы и группы сравнения
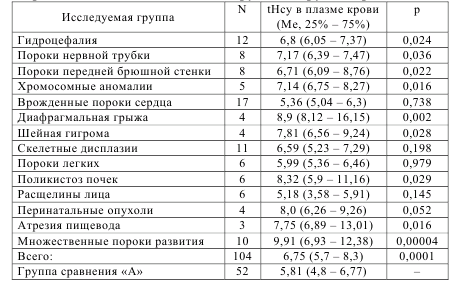
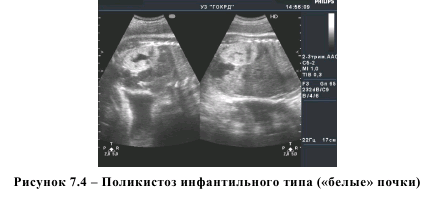
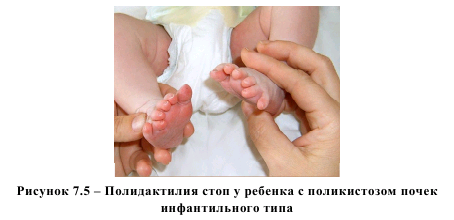
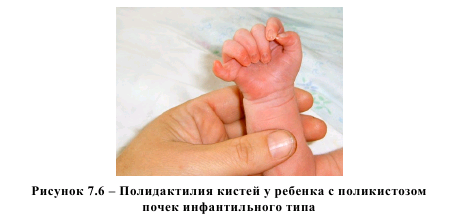
При анализе данных, приведенных в таблице 7.1, установлено, что содержание общего гомоцистеина в плазме крови было достоверно выше среди пациенток основной группы (p<0,001), однако при изучении его концентраций в зависимости от вида врожденных аномалий установлены существенные различия. В частности, выявлено достоверное повышение уровня общего гомоцистеина в плазме крови беременных женщин при пороках развития центральной нервной системы (p<0,05), пороках нервной трубки (p<0,05), пороках передней брюшной стенки (p<0,05), хромосомных аномалиях (p<0,05), шейной гигроме (p<0,05), диафрагмальной грыже (p<0,01), поликистозе почек (p<0,05) и атрезии пищевода (p<0,05). Наиболее высокие показатели общего гомоцистеина в плазме крови регистрировались в группе пациенток с множественными врожденными аномалиями у плода (p<0,001). Отмечено повышение концентрации гомоцистеина в плазме крови при скелетных дисплазиях и опухолях, возникших в перинатальном периоде, однако это повышение не носило статистически значимый характер (p>0,05). Наконец, при выявлении у плода расщелин лица, врожденных пороков сердца и пороков развития легких нами не установлено различий в содержании общего гомоцистеина в плазме крови беременных женщин (p>0,05). Пороки развития нервной трубки (анэнцефалия, энцефалоцеле, спинномозговая грыжа) – группа врожденных аномалий, в отношении которых получены многочисленные убедительные данные о связи дефицита фолатов и повышенного уровня гомоцистеина [8, 9, 13]. Полученные нами данные у 8 пациенток, уровень гомоцистеина у которых в плазме крови составил 7,17 (6,39-7,47) мкмоль/л, подтверждают подобную точку зрения. Показатели гомоцистеина в подгруппе беременных с наличием гидроцефалии у плода (12 случаев) также характеризовались статистически значимым повышением по отношению к группе сравнения – 6,8 (6,05-7,37) мкмоль/л. Интересно отметить, что у двух пациенток из этих подгрупп в анамнезе уже имелось прерывание беременности по медико-генетическим показаниям в связи с наличием у плодов пороков развития нервной трубки (spina bifida). Установленные факты, а также высокий уровень гомоцистеина в плазме крови этих беременных свидетельствует о «неслучайном» характере возникновения врожденных аномалий у их потомства. В подгруппу беременных женщин с наличием поликистоза почек у плода вошли 6 пациенток. Только в одном случае процесс носил односторонний характер, в остальных наблюдениях отмечалось поражение обеих почек (рисунок 7.4). Уровень гомоцистеина в плазме крови у пациенток этой подгруппы составил 8,32 (5,9-11,16) мкмоль/л. Нами отмечено, что у двоих пациенток этой подгруппы, у которых уровень гомоцистеина в плазме крови составлял 10 мкмоль/л и выше, отмечено сочетание патологии почек с полидактилией
стоп или кистей (рисунки 7.5 и 7.6). О сочетании поликистоза почек инфантильного типа и полидактилии в доступной нам литературе мы сообщений не встретили, сообщается лишь о сочетании гидронефроза с полидактилией [64].
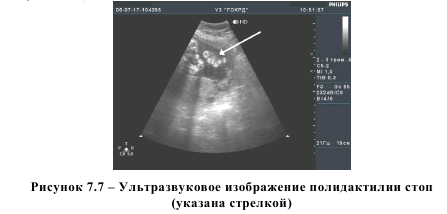
Данное наблюдение поспособствовало диагностике полидактилии в другом наблюдении. При выявлении поликистоза почек инфантильного типа мы целенаправленно изучали анатомию костной системы, что привело к визуализации изолированной полидактилии стоп (рисунок 7.7) в 33 недели беременности, что подтвердилось после рождения ребенка (рисунок 7.8).
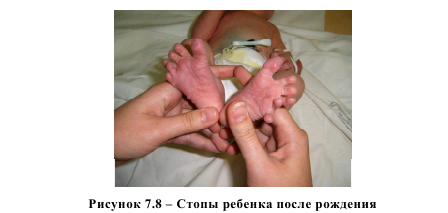
В нашем исследовании у одной из пациенток наблюдалось повторение подобной патологии у плода – в анамнезе у нее уже имелось прерывание беременности по медикогенетическим показаниям именно в связи с описываемой патологией. Интересно отметить, что у этой пациентки произведена конусовидная ампутация шейки матки по поводу рака шейки матки. Здесь следует указать, что, по мнению некоторых авторов, при раке шейки матки и предраковых состояниях шейки матки (дисплазии различной степени) также отмечается повышение уровня гомоцистеина в крови [65]. Гипергомоцистеинемия приводит к нарушению метилирования ДНК, что создает предпосылки для внедрения вирусов с онкогенными свойствами (вирус папилломы человека 16 и 18 типов) в геном клеток [66] с последующим развитием злокачественного новообразования.
Таким образом, есть основания предполагать, что сочетание подобной гинекологической патологии с пороками развития плода не является случайным, поскольку имеется один и тот же фактор риска, действие которого реализуется в различных плоскостях. Уровень гомоцистеина у пациенток при наличии хромосомной патологии (3 случая синдрома Дауна и 1 случай синдрома Клайнфельтера) или шейной гигромы у плода также был повышен. Возраст пациенток этой подгруппы составил 33 (30-35) года, а в подгруппе с наличием шейной гигромы 28,5 (24,5-34). В этих подгруппах отмечен самый «пожилой» для беременных возраст среди пациенток основной группы. Однако при проведении корреляционного анализа мы не обнаружили связей между возрастом обследованных женщин и уровнем гомоцистеина в плазме крови. Поскольку наличие шейной гигромы у плода в 70% случаев также ассоциируется с хромосомной патологией (синдром Тернера, трисомии по 13, 18, 21 паре хромосом) [3], то наши данные подтверждают общеизвестный постулат о повышении риска хромосомной патологии с увеличением возраста женщин [7].
Возможно, это связано и с нарушением метилирования ДНК. Следует более подробно остановиться на особенностях анамнеза у пациенток обсуждаемых подгрупп. У одной из женщин (в возрасте 43 лет на момент исследования), страдающей артериальной гипертензией, был зафиксирован самый высокий уровень гомоцистеина в плазме крови среди женщин основной группы – 35,62 мкмоль/л. У ее первого ребенка также был диагностирован синдром Дауна, ребенок умер в 15-летнем возрасте в связи с пороком сердца. У другой пациентки 35-летнего возраста в анамнезе имелась неразвивающаяся беременность, причем у плода при ультразвуковом исследовании была обнаружена шейная гигрома, что может также косвенно свидетельствовать о наличии у него хромосомной патологии [3]. У третьей пациентки за 4 года до проводимого нами исследования выявлен рак шейки матки (!), (возраст ее на момент беременности составил 30 лет), по поводу чего ей было проведено хирургическое лечение – конусовидная ампутация шейки матки. У оставшихся двух женщин подгруппы с подтвержденной хромосомной патологией у плода (в возрасте 26 и 32 лет) не отмечено каких-либо отклонений в состоянии соматического и гинекологического здоровья. В подгруппе с шейной гигромой у одной из пациенток (возраст ее 32 года) имелась дисплазии шейки матки (!) тяжелой степени, по поводу чего было также проведено хирургическое лечение в объеме конусовидной ампутации шейки матки. Интересна дальнейшая судьба этой женщины: через полгода после прерывания беременности и проведения адекватной прегравидарной подготовки наступила повторная беременность, которая протекала на фоне выраженной постоянной угрозы прерывания беременности и закончилась преждевременными родами в сроке 32 недели беременности, причем у ребенка имелись признаки задержки внутриутробного развития, а после рождения выявлен дефект межжелудочковой перегородки. Эти факты еще раз свидетельствуют о различных точках «приложения» патогенного действия гипергомоцистеинемии. Нами изучены показатели уровня гомоцистеина в плазме крови при аномалиях развития передней брюшной стенки (5 случаев омфалоцеле и 3 случая гастрошизиса) и при диафрагмальной грыже (4 случая).
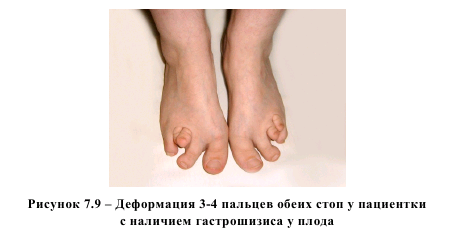
Эти пороки традиционно объединяются в одну группу в руководствах по пренатальной и ультразвуковой диагностике как пороки развития стенок брюшной полости [3]. В доступной нам литературе мы не встретили данных о роли повышенных концентраций гомоцистеина при формировании патологии подобного рода. Мы установили достоверное повышение уровня гомоцистеина в плазме крови беременных женщин с указанными видами аномалий развития. Возможно, повышенные концентрации этой аминокислоты во время эмбриогенеза способствуют нарушениям процесса нормального формирования передней брюшной стенки и диафрагмы. Интересно отметить, что именно в этой подгруппе мы наблюдали двух пациенток, у которых имелись пороки развития костной системы. У других пациенток основной группы каких-либо врожденных пороков развития выявлено не было. У первой пациентки отмечена врожденная деформация 3-4 пальцев обеих стоп (рисунок 7.9).
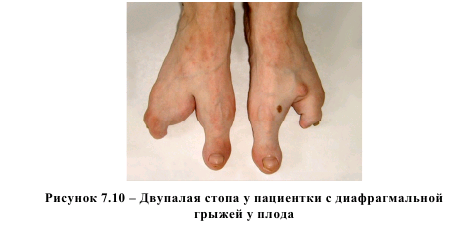
В другом случае у пациентки имелся врожденный порок развития костной системы – двупалая стопа (рисунок 7.10). Беременность с наличием у плода диафрагмальной грыжи была третьей, в анамнезе у этой женщины – рождение двух детей без каких-либо врожденных аномалий.
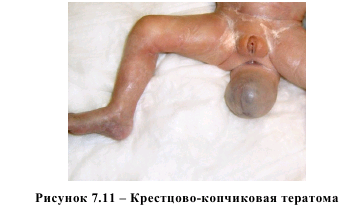
Все беременности у женщин с патологией развития передней брюшной стенки у плода были прерваны в сроке 1521 неделя. В подгруппе с диафрагмальными грыжами у плода в одном случае произведено прерывание беременности до 22недельного срока, в 3 случаях беременность была сохранена, поскольку врожденные аномалии развития впервые были выявлены при ультразвуковом исследовании после 22 недели внутриутробного развития. У всех пациенток произошли срочные роды, и все родившиеся дети были подвергнуты хирургическому лечению практически сразу после рождения. Из них один ребенок умер в первые сутки послеоперационного периода. Среди 11 пациенток с наличием у плода врожденной патологии скелета отмечен повышенный уровень гомоцистеина в плазме крови – 6,59 (5,23-7,29) мкмоль/л, хотя это повышение не носило статистически значимый характер (p>0,05). Возможно, это связано с большой разнородностью изучаемой патологии. Достаточно сказать, что к настоящему времени не имеется общепринятой пренатальной классификации скелетных дисплазий, насчитывающих более 200 различных форм. Основной причиной является отсутствие знаний о патогенезе этих состояний. Тем не менее, полученные нами данные и данные литературы [53, 54] свидетельствуют о вероятной «причастности» гомоцистеина в формировании врожденной патологии скелета. Учитывая разнородность этой патологии, только накопление достаточного количества фактического материала поможет установить истинную роль гомоцистеина в возникновении скелетных дисплазий. В подгруппе с опухолями у плода рассмотрены 4 случая доброкачественных новообразований, выявленных еще до рождения плода, гистологическая структура которых верифицирована после родов (3 случая) или после прерывания беременности по медико-генетическим показаниям (рисунок 7.11).
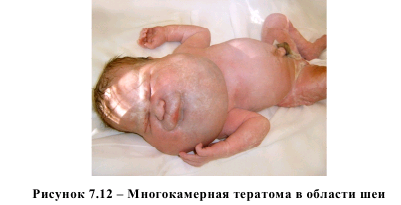
Все опухоли впервые обнаружены у плодов при ультразвуковом исследовании в сроки 22-24 недели беременности. Все родившиеся дети были подвергнуты оперативному лечению в разное время после родов. Это были случаи зрелой тератомы брюшной полости, крестцово-копчиковой тератомы и многокамерной тератомы в области шеи (рисунок 7.12). У этого ребенка в послеоперационном периоде развилась стриктура пищевода. Значения уровня гомоцистеина в плазме крови были достаточно высокими 8,0 (6,26-9,26) мкмоль/л, хотя статистически не значимыми (p>0,05). Возможно, это связано с небольшим количеством наблюдений (поскольку критерий p Манна-Уитни приближался по своему значению к 0,05). Следует отметить, что влияние гомоцистеина на процессы метилирования ДНК и канцерогенез имеют место на протяжении всей жизни, в том числе и в перинатальном периоде.
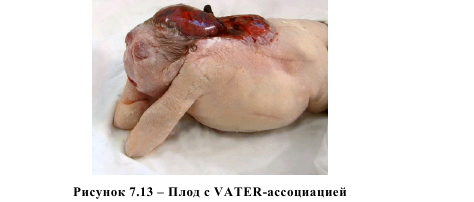
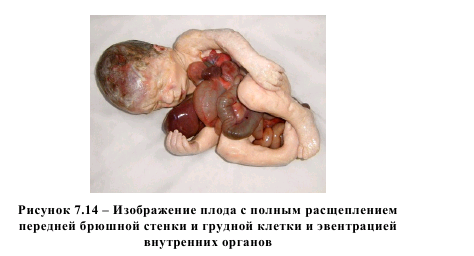
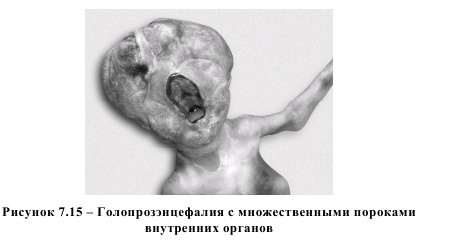
В литературных данных отсутствуют сведения о связи уровня гомоцистеина с возникновением атрезий пищевода. Возможно, это объясняется относительно редкой встречаемостью данного порока – частота выявления колеблется от 1:800 до 1 : 5000 живорожденных [3]. Мы располагаем тремя наблюдениями, в которых концентрация гомоцистеина в плазме крови статистически значимо превышала показатели в группе сравнения и составляла 7,75 (6,89-13,01) мкмоль/л (p<0,05). В одном случае порок был выявлен и прерван до 22 недель беременности. В другом наблюдении атрезия пищевода была диагностирована после 22 недель беременности, а родившийся ребенок умер в связи с пневмонией через 1 месяц после родов и после двух перенесенных оперативных вмешательств. В третьем случае (порок развития также диагностирован после 22 недель беременности) родившийся ребенок с аномалией развития был прооперирован в первые сутки с благоприятным исходом. Накопление фактических данных в отношении атрезии пищевода позволит пролить свет на роль гомоцистеина в формировании этой аномалии развития. В подгруппу множественных врожденных пороков развития у плода были включены 10 пациенток в случае выявления у плодов врожденных аномалий в 3 и более системах органов. У них отмечены наиболее высокие показатели уровня гомоцистеина 9,91 (6,93-12,38) мкмоль/л. Минимальное и максимальное значение гомоцистеина в плазме крови составляло 6,58 и 14,98 мкмоль/л, соответственно, а у половины пациенток уровень гомоцистеина превышал 10 мкмоль/л. Это были случаи наиболее грубых пороков развития плода, в которых зарегистрированы аномалии строения практически во всех органах и системах, как, например, на рисунках 7.13, 7.14 и 7.15.
Таким образом, в нашем исследовании показано, что 2-3-кратное повышение уровня гомоцистеина в плазме крови матери может ассоциироваться с грубыми аномалиями развития плода. Выявлена прямая корреляционная связь между уровнем гомоцистеина в плазме крови и количеством аномально сформированных систем плода, в которых выявлен порок развития (R=0,782; p<0,01). Это перекликается с существующим мнением о так называемом дозозависимом эффекте гомоцистеина на развивающийся эмбрион – чем выше концентрация гомоцистеина, тем более грубые пороки развития можно прогнозировать, что было доказано в экспериментальных работах [67]. Интересно отметить, что в этой же работе был доказан и протективный эффект фолиевой кислоты при высоких уровнях гомоцистеина, воздействовавших на эмбрион. Следует остановиться на обсуждении ситуаций с пороками развития плода, не сопровождавшимися повышением уровня гомоцистеина в плазме крови матери. В проведенном нами исследовании не выявлено существенных различий в уровне общего гомоцистеина в плазме крови беременных с наличием у плода врожденных пороков сердца, расщелин верхней губы и твердого неба и пороков развития легких. Мы не располагаем литературными данными, свидетельствующими о влиянии гипергомоцистеинемии на возникновение пороков легких. Уровень гомоцистеина в 6 наблюдениях был практически идентичен показателям в группе сравнения (p>0,05). Имеется достаточное количество литературных данных о роли повышенного уровня гомоцистеина в генезе врожденных пороков сердца [29], однако мы не получили подобных данных в своем исследовании. В этих работах делается акцент на так называемые конотрункальные дефекты, т.е. аномалии развития магистральных сосудов. Нами обследовано 17 пациенток с различными видами изолированных ВПС. Спектр выявленных аномалий сердца представлен в таблице 7.2.
Установлено, что уровень гомоцистеина не коррелировал с анатомической формой порока. Наиболее высокие показатели гомоцистеина в плазме крови наблюдались при полной форме атривентрикулярной коммуникации с транспозицией магистральных сосудов (8,89 мкмоль/л) и при наличии тетрады Фалло (9,33 мкмоль/л). В данном случае в определенной степени прослеживается «дозозависимый» эффект гипергомоцистеинемии. Интересно отметить, что в подгруппе с МВПР в 50% у плодов зарегистрирован порок сердца, а наиболее «грубый» порок наблюдался при уровне гомоцистеина 14,98 мкмоль/л (аплазия легочного ствола, атриовентрикулярная коммуникация, выход аорты из правого желудочка, атрезия легочных вен). Нами не получено данных, свидетельствующих о роли гомоцистеина в происхождении изолированных расщелин лица и твердого неба, хотя литературные данные подтверждают подобную точку зрения. Мы также не отметили ни одного случая расщелин лица в случаях МВПР. В данной ситуации имеется определенное противоречие: почему нет сочетания спинномозговой грыжи и расщелины лица или сочетания порока сердца и расщелины верхней губы при наличии одного и того же предполагаемого фактора риска? Указанные пороки практически всегда встречаются изолированно друг от друга. Однако возможной причиной отсутствия подобных комбинаций может быть самопроизвольное прерывание беременности на раннем сроке. Исходя из литературных данных [3], сочетание пороков нервной трубки (анэнцефалия, spina bifida) с расщелинами лица встречается только в 2% случаев. В нашем исследовании мы столкнулись с подобной ситуацией (рисунок 7.16), но это был единственный случай, при котором уровень гомоцистеина в плазме крови составил 7,49 мкмоль/л.
Минимальное и максимальное значения уровня общего гомоцистеина в плазме крови беременных женщин в случаях расщелин верхней губы и твердого неба составили 3,10 и 6,59 мкмоль/л, соответственно, причем, не отмечено зависимости между уровнем гомоцистеинемии и степенью анатомического дефекта. Иными словами, примерно при одном и том же уровне гомоцистеина в плазме крови матери у плода могли наблюдаться изолированный односторонний дефект верхней губы (рисунок 7.17), либо расщелина лица с распространением дефекта на верхнюю челюсть (рисунок 7.18).
Учитывая полученные данные можно предположить, что возникновение изолированных расщелин лица не связано с патогенным действием гомоцистеина. Возможно, это воздействие опосредованное, так как гомоцистеин влияет на процессы апоптоза, которые играют важную роль в формировании различных полостей тела. Вероятно, высокий уровень гомоцистеина не является обязательным фактором для формирования порока подобного типа.
Содержание гомоцистеина в отмытых эритроцитах
Данные о концентрации общего гомоцистеина в отмытых эритроцитах представлены в таблице 7.3.
Таблица 7.3 – Уровень общего гомоцистеина в отмытых эритроцитах беременных женщин основной группы и группы сравнения
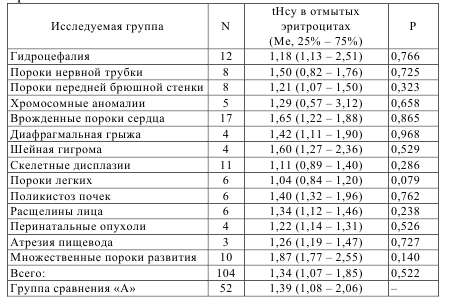
В отмытых эритроцитах содержание общего гомоцистеина среди женщин основной группы и группы сравнения не имело различий (p > 0,05). Не отмечено также различий и при различных видах врожденной патологии у плода. Данный факт свидетельствует о том, что клетки активно «избавляются» от гомоцистеина либо путем его катаболизма, либо путем элиминирования его из клетки.
Содержание гомоцистеина в околоплодных водах
В литературе имеются единичные работы об уровне гомоцистеина в околоплодных водах, в связи с чем для нас эта область исследований имела определенно «повышенный» интерес. Показатели уровня общего гомоцистеина в околоплодных водах беременных основной группы и группы сравнения «В» представлены в таблице 7.4.
Таблица 7.4 – Уровень общего гомоцистеина в околоплодных водах у беременных основной группы и группы сравнения
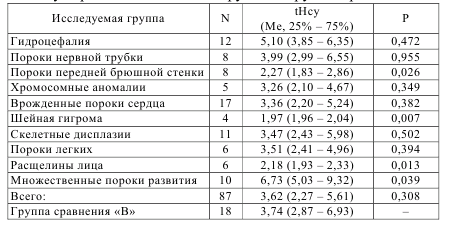
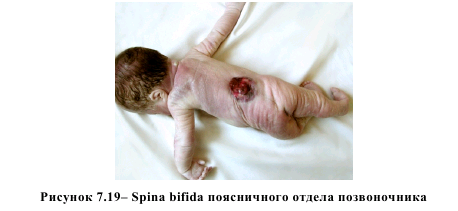
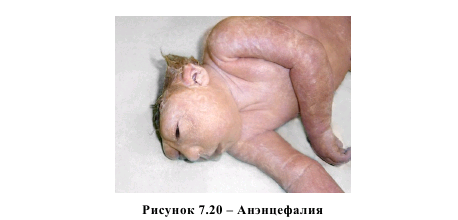
Нами не выявлено различий в концентрации общего гомоцистеина в околоплодных водах среди женщин основной группы и группы сравнения (p > 0,05). Но при анализе различных видов врожденных аномалий развития у плода установлено статистически значимое повышение уровня общего гомоцистеина при МВПР (p < 0,05), а также достоверное снижение его при расщелинах верхней губы и неба (p < 0,05), шейных гигромах (p < 0,01) и аномалиях развития передней брюшной стенки у плода (p < 0,05). Мы не отметили различий в уровне гомоцистеина в околоплодных водах у пациенток с пороками нервной трубки в зависимости от уровня дефекта – спинномозговая грыжа поясничного отдела позвоночника (рисунок 7.19) либо анэнцефалия (рисунок 7.20), на что указывается в литературных источниках [8]. При анэнцефалии (n = 3) медиана значения гомоцистеина составила 3,57 мкмоль/л, а при spina bifida поясничного отдела позвоночника (n = 5) – 4,02 мкмоль/л, что оказалось статистически недостоверным (p = 0,655).
При изучении корреляционных связей установлено, что в основной группе имеется положительная корреляционная связь между уровнем гомоцистеина в плазме крови и количеством родов (R=0,21; p<0,05) и выкидышей (R=0,20; p<0,05) в анамнезе, т.е. чем больше паритет беременностей, независимо от их исхода, тем выше уровень гомоцистеина в плазме крови. Это можно объяснить повышенным расходом фолатов в организме, необходимых для роста и развития плода и экстраэмбриональных структур [13]. Отмечена положительная корреляционная связь между гомоцистеином плазмы матери и гомоцистеином эритроцитов (R=0,27; p<0,05), а также между гомоцистеином эритроцитов матери и гомоцистеином околоплодных вод (R=0,34; p<0,05) среди беременных основной группы.
Выявленные корреляционные связи между концентрациями гомоцистеина в различных биологических субстратах могут свидетельствовать, во-первых, о «клеточном» происхождении гомоцистеина, а, во-вторых, могут указывать на то, что гомоцистеин легко преодолевает плацентарный барьер, а его уровень в крови беременных является определенным эквивалентом, отражающим содержание его в клетках матери (материнское происхождение) и околоплодных водах (плодовое происхождение).
Диагностическая значимость определения уровня гомоцистеина в плазме крови и амниотической жидкости При изучении показателей чувствительности и специфичности теста в целях диагностики врожденных пороков развития плода по уровню общего гомоцистеина в плазме крови установлено, что при точке разделения 7,91 мкмоль/л чувствительность теста составляет 26,92 %, а специфичность 96,15% [68].
Операционные характеристики теста представлены в таблице 7.5.
Таблица 7.5 – Операционные характеристики и параметры информативности теста определения уровня гомоцистеина в плазме крови для выявления пороков развития плода
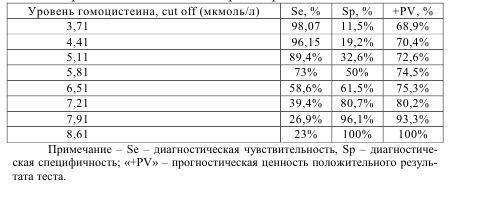
Несмотря на невысокую чувствительность и относительно небольшое количество сформированных пороков при уровне гомоцистеина в плазме более 7,91 мкмоль/л, следует отметить, что это были наиболее трудные для пренатальной диагностики состояния или пороки с весьма сомнительным прогнозом даже при своевременно проведенном хирургическом лечении. Это 75% всех диафрагмальных грыж, 50% от всего количества выявленных МВПР, опухолей, возникших в перинатальном периоде, поликистозов почек, шейных гигром, 30% хромосомных аномалий и атрезий пищевода. Остальные пороки, при которых гомоцистеин был не столь высок, достаточно хорошо диагностируются при динамическом ультразвуковом скрининге – гидроцефалия, пороки передней брюшной стенки, скелетные дисплазии. Наиболее трудную задачу для диагностики представляют собой ВПС из-за особенностей внутриутробной гемодинамики, «неудобного» положения плода, а также из-за необходимости использования высококачественного оборудования и отсутствия достаточного количества квалифицированных специалистов для пренатальной эхокардиографии. Тем не менее, опыт зарубежных стран показывает, что при обучении врачей ультразвуковой диагностики основам фетальной эхокардиографии неизбежно повышается эффективность выявления пороков сердца [4]. К тому же, стремительное развитие кардиохирургии способствует радикальному излечению ранее неоперабельных пациентов. Из 28 пациенток с уровнем общего гомоцистеина в плазме крови более 7,91 мкмоль/л у 14 беременность закончилась рождением детей. Четыре ребенка (28,5%) умерли в течение месяца жизни: двое от МВПР, один – после оперативного лечения диафрагмальной грыжи, один – после оперативного лечения атрезии пищевода. 7 детей (50%) подверглись оперативному лечению по поводу диафрагмальной грыжи (2 случая), врожденных пороков сердца (2 случая), поликистоза почки, крестцово-копчиковой тератомы и многокамерной тератомы в области шеи – по одному случаю. В течение 6 месяцев жизни после операций состояние этих детей было удовлетворительным, за исключением ребенка с тератомой шеи – у него развилась стриктура пищевода. Наконец, трое детей находятся под наблюдением урологов по поводу поликистоза почек инфантильного типа (2 случая) и педиатра (синдром Дауна). Приведенные данные говорят о серьезных экономических и социальных затратах на лечение детей с врожденными аномалиями развития. Несмотря на недостаточно высокую чувствительность теста, он позволяет сформировать группу риска среди беременных женщин по возникновению наиболее тяжелых врожденных аномалий. Кроме того, высокий уровень гомоцистеина может свидетельствовать о риске неблагоприятного течения беременности, а именно, привычная потеря беременности в ранние сроки, гипертензивные расстройства, синдром задержки внутриутробного развития плода, склонность к тромбофилическим состояниям, что позволит выявлять и своевременно лечить все выявленные состояния. Нами рассчитаны операционные характеристики теста определения уровня гомоцистеина в околоплодных водах для выявления пороков развития плода. Для удобства анализа в таблице 7.6 мы приводим данные об уровне гомоцистеина в околоплодных водах при обсуждаемых видах пороков как отдельно, так и в общем виде.
Таблица 7.6 – Значения уровня общего гомоцистеина (мкмоль/л) в околоплодных водах у пациенток основной группы с отдельными видами аномалий развития у плода и группы сравнения
Установлено, что при концентрации гомоцистеина в амниотической жидкости менее 2,5 мкмоль/л диагностическая чувствительность теста для выявления расщелин лица, шейной гигромы и пороков передней брюшной стенки у плода составляет 71,4%, диагностическая специфичность – 83,3%, а прогностическая ценность положительного результата – 76,9% [69].
Содержание продуктов транссульфурирования в плазме крови, отмытых эритроцитах и амниотической жидкости
При анализе данных, приведенных в предыдущих разделах, обращает на себя внимание тот факт, что при достаточно высоких показателях гомоцистеина в плазме крови матери (6-8 мкмоль/л) пороки развития плода не возникали и наоборот – низкий уровень гомоцистеина в крови матери не гарантировал отсутствие врожденных аномалий развития у плода. В связи с этим представляет интерес изучение концентраций метаболитов гомоцистеина, в частности субстратов, образующихся при транссульфурировании. В этом процессе метаболизируется около 70% всего гомоцистеина [70], и указанная биохимическая цепочка является единственным источником образования цистеина и глутатиона. Мы проводили изучение уровней цистеина, цистеинглицина и глутатиона во всех полученных нами для исследования субстратах, однако для удобства восприятия мы приводим только данные, представляющие наибольший интерес. Нами установлено достоверное повышение уровня серосодержащей аминокислоты цистеина в плазме крови беременных женщин основной группы (p<0,05). Это повышение наблюдалось практически при всех видах аномалий, а при наличии диафрагмальной грыжи и МВПР это носило статистически значимый характер (p<0,05). При изучении содержания продуктов транссульфурирования в отмытых эритроцитах выявлена тенденция к снижению синтеза глутатиона практически во всех рассматриваемых случаях, а при врожденных пороках сердца у плода это снижение оказалось статистически достоверным (p<0,05). По мнению некоторых авторов [71, 72], подобное явление может наблюдаться при перенесенной вирусной инфекции. Следует отметить, что 64,7% женщин (больше, чем в какой-либо другой подгруппе) с врожденными пороками сердца у плода на раннем сроке беременности перенесли острое респираторное вирусное заболевание. Возможно, в генезе врожденных пороков сердца имеет значение не только непосредственное воздействие высоких концентраций гомоцистеина, но и связанные с ними оксидативный стресс и стресс эндоплазматической сети.

Более наглядно особенности транссульфурирования характеризуются при изучении соотношений концентраций гомоцистеина, цистеина и глутатиона между собой в плазме крови и отмытых эритроцитах, что представлено в таблице 7.8.
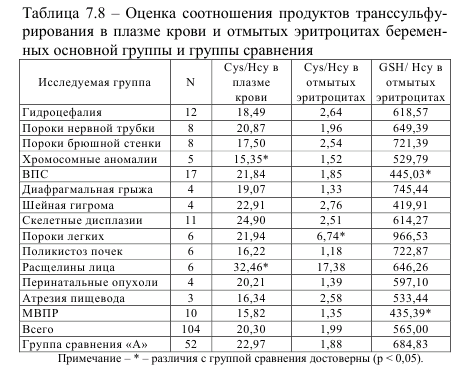
Достоверное снижение соотношения цистеин/гомоцистеин в плазме крови при хромосомных аномалиях (p<0,05) может свидетельствовать о нарушении процесса транссульфурирования. Имеется явная тенденция к снижению этого соотношения при МВПР, атрезиях пищевода, поликистозе почек и пороках передней брюшной стенки. Выявлено также достоверное повышение обсуждаемого коэффициента в подгруппе беременных с расщелинами лица у плода (p<0,05). Подобное наблюдение может свидетельствовать о токсичности цистеина при наличии его в больших количествах. Роль цистеина в генезе пороков развития плода изучена крайне недостаточно. Имеются единичные работы, в которых указывается связь повышенных концентраций цистеина и осложнений беременности [73, 74], в том числе обнаружена и ассоциация с возникновением врожденных аномалий. Если учесть, что основными ферментами транссульфурирования являются В6-зависимые энзимы, для профилактики врожденной патологии в качестве преконцептивной подготовки можно рекомендовать не только прием фолиевой кислоты, но и обязательный прием пиридоксина в обычных дозировках. На основании изучения соотношения различных метаболитов транссульфурирования в эритроцитах нами показано повышение содержания цистеина в эритроцитах при пороках развития легких, на что указывает коэффициент цистеин/гомоцистеин.
Полученные данные опять же могут свидетельствовать о токсичности цистеина. Как снижение внутриклеточного содержания глутатиона, так и снижение коэффициента глутатион/гомоцистеин в отмытых эритроцитах свидетельствует о нарушении антиоксидантной защиты клетки. Снижение соотношения глутатион/гомоцистеин в отмытых эритроцитах отмечено практически у всех беременных с различными пороками развития плода, и это оказалось достоверным при множественных врожденных пороках развития плода и врожденных пороках сердца (p<0,05). Это может быть показателем оксидативного стресса. Нами рассчитаны чувствительность, специфичность и прогностическая ценность положительного результата теста для выявления врожденных пороков сердца на основании изучения соотношения «глутатион/гомоцистеин» в отмытых эритроцитах. Установлено, что при значениях указанного коэффициента в пределах 300-500 диагностическая чувствительность теста составляет 41,6%, диагностическая специфичность – 70,7%, а прогностическая ценность положительного результата – 22,6%, что может служить дополнительным диагностическим критерием для выявления врожденных пороков сердца и МВПР плода [75]. Среди продуктов транссульфурирования гомоцистеина, содержащихся в околоплодных водах (таблица 7.9) отмечена тенденция к повышению уровня цистеина при гидроцефалии, хромосомных аномалиях и МВПР, а также достоверное снижение его при расщелинах лица (р<0,05). Механизм снижения уровня гомоцистеина в околоплодных водах при некоторых видах врожденных аномалий развития у плода, что указывалось ранее, неизвестен, как неизвестен и механизм снижения содержания цистеина при расщелинах верхней губы и твердого неба.
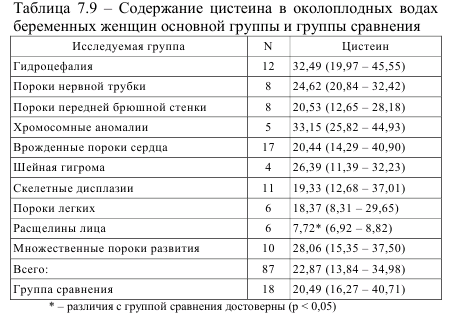
Эта проблема требует дальнейшего углубленного изучения. Показатель соотношения цистеин/гомоцистеин в околоплодных водах основной группы и группы сравнения составил 6,44 и 5,05, соответственно. При хромосомных аномалиях это соотношение составило 12,87 и было статистически достоверным (р = 0,013). Выявленные особенности указывают на многообразие патогенетических звеньев, приводящих к формированию различных видов врожденных аномалий у плода, что требует дальнейшего изучения для разработки соответствующих профилактических мер и способов коррекции имеющихся метаболических нарушений. Нами выявлен ряд корреляционных связей между метаболитами процесса транссульфурирования гомоцистеина как в плазме крови и отмытых эритроцитах, так и в околоплодных водах пациенток основной группы.
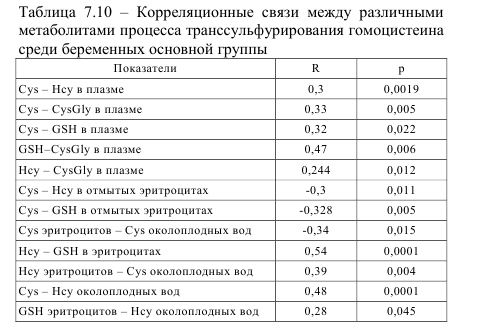
В группе сравнения прослеживались подобные корреляционные связи, а при различных пороках эти корреляции не отмечены, что, вероятно, указывает на метаболические нарушения при определенных состояниях. Например, обнаруженная корреляционная связь между содержанием гомоцистеина и глутатиона в отмытых эритроцитах не выявлена в подгруппе с врожденными пороками сердца у плода, при которых, как было показано, имеет место снижение наработки глутатиона.
Выводы
Значительное количество врожденных аномалий развития у плода сопровождается повышенным уровнем гомоцистеина в плазме крови матери, что характерно для таких аномалий развития как пороки центральной нервной системы, пороки передней брюшной стенки, диафрагмальные грыжи, атрезии пищевода, поликистоз почек, шейная гигрома и множественные врожденные аномалии плода. При возникновении у плода расщелины лица, пороков развития легких и врожденных пороков сердца не установлено различий в концентрации гомоцистеина в плазме крови беременных женщин. Уровень гомоцистеина в околоплодных водах достоверно повышен при множественных врожденных пороках развития плода. Установлено достоверное снижение концентрации гомоцистеина в амниотической жидкости при расщелинах лица, шейной гигроме и пороках передней брюшной стенки, а также достоверное снижение уровня цистеина в околоплодных водах при расщелинах лица. Определение уровня гомоцистеина в плазме крови и околоплодных водах, а также продуктов его метаболизма является диагностическим критерием врожденных аномалий развития плода.
При концентрации гомоцистеина в плазме крови 7,91 мкмоль/л, чувствительность метода составляет 26,9%, специфичность – 96,1%, прогностическая ценность положительного результата – 93,3%, что позволяет формировать группы женщин на ранних сроках беременности для проведения углубленной диагностики с целью выявления ВПР плода. Достоверное снижение уровня внутриклеточного глутатиона и снижение соотношения «глутатион/гомоцистеин» в отмытых эритроцитах может служить диагностическим критерием для выявления ВПС и МВПР у плода. Показатели уровня гомоцистеина в плазме крови беременных могут быть использованы в качестве диагностического маркера ВПР плода. Это позволит провести углубленную диагностику с использованием ультразвуковой аппаратуры высокого или экспертного класса либо с применением инвазивных методов пренатальной диагностики, что будет способствовать снижению перинатальных потерь. Целесообразно также определять уровень глутатиона в отмытых эритроцитах и соотношение глутатион/гомоцистеин для выявления врожденных пороков сердца. Определение уровня гомоцистеина в околоплодных водах необходимо использовать в медико-генетических центрах, занимающихся инвазивными методами пренатальной диагностики в качестве дополнительного диагностического критерия для выявления некоторых врожденных пороков развития у плода (шейная гигрома, пороки передней брюшной стенки, расщелины лица).